Chapitres physique-chimie en Première
Cours sur les dosages colorimétriques en 1ère
Résumé de cours Exercices et corrigés
Cours en ligne de physique chimie en Première
Ce cours en ligne de physique chimie en première vous servira pour travailler le cours de spécialité sur les dosages colorimétriques. Vous retrouverez notamment les éléments suivants : dosage par étalonnage et dosage par titrage. Si vous souhaitez vous faire accompagner, n’hésitez pas à consulter nos cours particuliers en physique et chimie. Nos professeurs particuliers en 1ère pourront vous aider à mieux appréhender ces notions importantes pour le passage en terminale et pour le bac.
Vous pouvez consulter d’autres résumés de cours de physique chimie en première sur notre site : les molécules organiques, les synthèses organiques, l’interaction et champs, etc.
Dosage par étalonnage en 1ère
1. Absorbance
Une solution apparaît colorée, car elle absorbe certaines des radiations de la lumière.
Pour une longueur d’onde donnée ![]() (correspondant à une couleur dans le spectre de la lumière visible), l’absorbance de la solution, notée
(correspondant à une couleur dans le spectre de la lumière visible), l’absorbance de la solution, notée ![]() , sans unité, mesure la capacité de la solution à absorber la longueur d’onde
, sans unité, mesure la capacité de la solution à absorber la longueur d’onde ![]() .
.
La courbe d’absorbance d’une solution est le graphique donnant ![]() en fonction de
en fonction de ![]() .
.
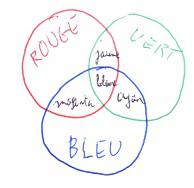
La couleur de la solution est la couleur complémentaire de la principale couleur absorbée, celle dont l’absorbance est maximale. On peut utiliser le cercle chromatique suivant.
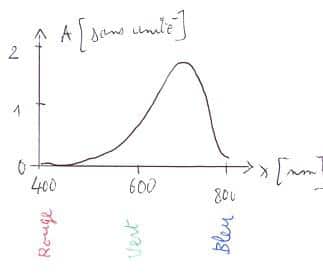
Exemple : Quelle est la couleur apparente de la solution dont l’absorbance est donnée sur le graphique précédent ?
Correction : L couleur absorbée est dans le domaine du bleu. La couleur est le complémentaire du bleu, dans la case du cercle chromatique opposée au bleu, la solution paraît jaune.
COURS DE PHYSIQUE CHIMIE
Gagner en autonomie avec les meilleurs profs
Des cours de grande qualité
Avis Google France ★★★★★ 4,9 sur 5
2. Loi de Beer-Lambert en première
On considère une solution d’un composé unique, le soluté.
L’absorbance de cette solution dépend de trois paramètres :
![]()
* ![]() est le coefficient d’absorption molaire du soluté, exprimée en
est le coefficient d’absorption molaire du soluté, exprimée en ![]()
* ![]() est l’épaisseur de solution traversée par le faisceau analysé, c’est aussi la largeur de la cuve dans laquelle on place l’échantillon analysé, cuve introduite dans le spectrophotomètre ;
est l’épaisseur de solution traversée par le faisceau analysé, c’est aussi la largeur de la cuve dans laquelle on place l’échantillon analysé, cuve introduite dans le spectrophotomètre ; ![]() est exprimée en cm.
est exprimée en cm.
* ![]() est la concentration du soluté, exprimée en
est la concentration du soluté, exprimée en ![]()
Ainsi, la loi de Beer-Lambert donne accès à la concentration du soluté. On peut donc l’utiliser pour déterminer cette concentration, mais on va voir qu’il existe un moyen plus simple pour déterminer ![]() .
.
3. Dosage par étalonnage : échelle de teintes.
Retrouvez cette partie de cours sur le dosage par étalonnage : échelle de teintes dans notre application mobile gratuite PrepApp à télécharger sur Google play ou Apple store.
4. Dosage par étalonnage : utilisation d’un spectrophotomètre.
Cette partie de résumé de cours sur le dosage par étalonnage : utilisation d’un spectrophotomètre est à retrouver dans l’appli mobile PrepApp.
Dosage et colorimétrique 1ère : Dosage par titrage
1. Principe d’un dosage par titrage.
* Doser une solution, c’est déterminer la concentration d’une espèce chimique présente dans cette solution.
* On parle de titrage quand c’est une réaction chimique qui intervient pour doser l’espèce.
* Une réaction de titrage entre une espèce titrante et l’espèce dosée doit être
- unique
- rapide
- totale.
Lorsque l’espèce dosée a complètement disparu, on dit qu’on est à l’équivalence : l’espèce titrante et l’espèce dosée ont été mélangées dans les proportions stœchiométriques.
On en déduit la concentration de l’espèce dosée par un calcul de quantités de matière grâce au tableau d’avancement de la réaction de titrage.
Questions diverses :
a. Comment mesure-t-on la quantité précise de solution à doser ?
b. Dans quel type de récipient introduit-on cette solution ?
c. Dans quel type de récipient introduit-on la solution titrante ?
d. Comment mesure-t-on la quantité de solution titrante versée à l’équivalence ?
Correction :
a. On mesure la quantité de solution à doser avec une pipette.
b. On introduit la solution à doser dans un bécher.
c. On introduit la solution titrante dans une burette, permettant de la verser aussi lentement que nécessaire, voire au goutte à goutte, dans le bécher.
d. On mesure le volume de solution titrante versée à l’équivalence par lecture des graduations de la burette.
COURS DE CHIMIE
Nous avons sélectionné pour vous les meilleurs profs particuliers.
POUR ACCÉLÉRER MA PROGRESSION EN CHIMIE, JE TROUVE DES
Avis Google France ★★★★★ 4,9 sur 5
Consultez les parties de résumés de cours suivantes en téléchargeant notre application mobile PrepApp :
2. Repérage de l’équivalence par changement de couleur
3. Détermination de la concentration de l’espèce grâce à un tableau d’avancement.
Retrouvez d’autres cours en ligne gratuits en 1ère sur notre site :

