Cours en ligne Physique-Chimie en Maths Spé
Chapitres Physique-Chimie en MP, PSI, PC, MPI, TSI, PT
Cours sur l’électrochimie en MP, PC, PSI et MPI
Résumé de cours Exercices et corrigés
Ce cours de physique chimie gratuit, spécialement conçu pour les étudiants en CPGE, est une ressource inestimable pour aborder le sujet de l’électrochimie en maths spé. Nous explorerons les notions suivantes en electrochimie tels que les courbes courant-potentiel, corrosion, les piles, électrolyseurs et les accumulateurs. Si vous souhaitez améliorer encore davantage votre niveau ou combler vos lacunes, nous vous encourageons vivement à envisager à consulter nos profs en physique chimie.
Courbes courant-potentiel en maths spe
Méthode 1. Lire et interpréter une courbe courant-potentiel.
On doit connaître un petit nombre de formes de référence, le ou les mot(s) de vocabulaire adapté(s) et quelques bribes d’interprétation sommaires.
1. Au point d’intersection de la courbe avec l’axe des abscisses (![]() donc équilibre thermodynamique), le potentiel est égal au potentiel de Nernst
donc équilibre thermodynamique), le potentiel est égal au potentiel de Nernst ![]() du couple.
du couple.
2. À droite de ce point (![]() ) on est dans la zone anodique,
) on est dans la zone anodique, ![]() oxydation. À gauche (
oxydation. À gauche (![]() ), on est dans la zone cathodique,
), on est dans la zone cathodique, ![]() réduction.
réduction.
3. Si la pente de la courbe est strictement positive en ce point, le système est rapide : c’est le cas quand les ions ont un accès facile à l’électrode, ou s’en éloignent facilement, et quand l’électrode est faite dans le métal qui s’oxyde.
4. Si la pente de la courbe est nulle en ce point, le système est lent. C’est le cas quand l’accès des ions à l’électrode est rendue difficile à cause de la présence d’impuretés, ou de bulles de gaz, quand les électrons se déplacent difficilement vers la périphérie de l’électrode à cause de la présence d’espèces parasites peu ou pas conductrices.
5. Pour un système lent, ![]() ne devient significativement non nulle que pour
ne devient significativement non nulle que pour ![]() dans la zone anodique
dans la zone anodique
(![]() est la surtension anodique) et pour
est la surtension anodique) et pour ![]() dans la zone anodique (
dans la zone anodique (![]() est la surtension cathodique).
est la surtension cathodique).
6. Dans les zones actives, la pente peut tendre vers zéro à fort potentiel, il y a saturation due à l’existence d’un courant limite de diffusion (impossible de dépasser une certaine valeur d’intensité car les ions ont un mouvement de diffusion limité)
7. Lorsque le potentiel atteint et dépasse celui d’oxydation ou de réduction du solvant, on dit qu’on atteint le mur du solvant, et le potentiel ne peut plus dépasser une valeur extrême (asymptote verticale) ; toute oxydation ou réduction dont le potentiel de Nernst dépasse cette valeur est bloquée.
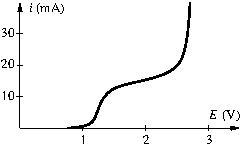
Exemple.
Dans la courbe suivante, déterminer le potentiel de Nernst, la surtension anodique, le courant limite de diffusion, le potentiel du mur du solvant.
Méthode 2. Utiliser les courbes courant-potentiel pour déterminer un point de fonctionnement.
Une réaction d’oxydoréduction met en jeu l’oxydation d’une espèce et la réduction d’une autre. Lorsqu’ils sont mis au contact l’un de l’autre, cela revient à créer un court-circuit entre deux demi-piles rédox.
1. On a alors égalité des potentiels
(![]() )
)
2. Selon la règle d’orientation du courant (le courant plonge dans le solution), les intensités sont opposées (![]() )
)
3. Par une méthode graphique, on trace sur le même graphique
* la partie anodique (avec un A) du couple dont l’espèce s’oxyde (oxydAtion)
* et la partie cathodique (avec un C) du couple dont l’espèce se réduit (réduCtion)
et on cherche deux points de même abscisse (![]() ) et d’ordonnées opposées (
) et d’ordonnées opposées (![]() )
)
4. La valeur du potentiel s’appelle le potentiel mixte (un peu comme le prix de vente effective entre un acheteur qui accepte de monter son prix à partir de son prix initial d’achat et un vendeur qui accepte de diminuer son prix).
5. L’intensité de fonctionnement
(![]() ) permet de calculer la vitesse de réaction, puis de calculer les durées des processus rédox selon la formule
) permet de calculer la vitesse de réaction, puis de calculer les durées des processus rédox selon la formule
![]() où
où ![]() est le nombre d’électrons échangés dans la réaction rédox équilibrée,
est le nombre d’électrons échangés dans la réaction rédox équilibrée, ![]() la constante de Faraday et
la constante de Faraday et ![]() la vitesse de réaction molaire.
la vitesse de réaction molaire.
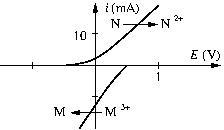
Exemple.
Les courbes suivantes sont relatives à la réaction
![]()
Déterminer la vitesse de réaction ![]() et celle de disparition de
et celle de disparition de ![]()
Corrosion en CPGE
Méthode 1. Définir les couples de l’eau.
1. Les deux couples sont
![]() :
: ![]()
![]() :
: ![]()
2. Les demi-équations rédox associées s’écrivent de façon canonique avec ![]()
![]()
![]()
3. On en déduit les potentiels de Nernst
![]()
![]()
Si on admet que les bulles de dihydrogène et de dioxygène sont à la pression atmosphérique ![]() , on obtient les équations de droite bien connues
, on obtient les équations de droite bien connues
![]() et
et ![]()
4. Mais deux problèmes habituels de compréhension de la corrosion apparaissent souvent :
a. pourquoi le couple ![]() est-il considéré comme un couple de l’eau alors qu’il ne fait pas figurer
est-il considéré comme un couple de l’eau alors qu’il ne fait pas figurer ![]() ?
?
b. la présence de ![]() dans les deux demi-équations rédox entraîne-t-elle qu’on se place systématiquement en milieu acide, alors qu’on parle de corrosion humide et que ni l’eau douce ni l’eau de mer ne sont particulièrement acides ?
dans les deux demi-équations rédox entraîne-t-elle qu’on se place systématiquement en milieu acide, alors qu’on parle de corrosion humide et que ni l’eau douce ni l’eau de mer ne sont particulièrement acides ?
On résout ces deux difficultés en écrivant les demi-équations rédox un peu différemment, en ajoutant ![]() à la première et
à la première et ![]() à la seconde, et en utilisant l’équation d’autoprotolyse de l’eau
à la seconde, et en utilisant l’équation d’autoprotolyse de l’eau
![]()
On obtient ainsi
![]()
qui signifie que le dioxygène dissous dans l’eau agit comme un oxydant, et qu’après oxydation, la solution devient basique (on peut le mettre en évidence avec un indicateur coloré).
![]()
qui signifie que l’eau agit comme un oxydant, et qu’on eut observer un dégagement de dioxygène.
Les lois de la chimie quantitative permettent de prouver que les potentiels de Nernst des couples ne dépendant pas de la manière d’équilibrer les demi-équations rédox, et donc que les équations de droite écrites plus haut restent valables.
Exemple.
Un couple rédox ![]() a pour potentiel de Nernst
a pour potentiel de Nernst ![]() (il est donc supposé indépendant du pH).
(il est donc supposé indépendant du pH).
Pour quelles valeurs du pH l’espèce ![]() peut-elle être stable dans l’eau aérée (chargée en dioxygène dissous) ?
peut-elle être stable dans l’eau aérée (chargée en dioxygène dissous) ?
COURS DE CHIMIE
Une équipe pédagogique à l’écoute des familles
Planifiez votre premier cours en quelques minutes
Avis Google France ★★★★★ 4,9 sur 5
Méthode 2. Prévoir les réactions de corrosion humide par étude du diagramme potentiel pH.
1. On trace les deux droites des couples de l’eau sur le diagramme potentiel pH d’un métal ![]() donné.
donné.
2. Le métal ![]() ou un de ses dérivés coexiste avec l’une des formes des couples de l’eau si les domaines d’existence possèdent une intersection. Il y a oxydation si les domaines sont disjoints.
ou un de ses dérivés coexiste avec l’une des formes des couples de l’eau si les domaines d’existence possèdent une intersection. Il y a oxydation si les domaines sont disjoints.
3. On délimite ainsi les zones
* d’immunité du métal (le métal peut coexister avec l’eau aérée (contenant du ![]() ou pas)
ou pas)
* de corrosion du métal (le métal est oxydé et se transforme en ion, solvaté et évacué par l’eau
* de passivité du métal (le métal est oxydé et transformé en un oxyde étanche (il bloque l’accès des espèces oxydantes est celui des ions) et souvent isolant (il bloque les mouvements d’électrons) qui forme une couche protectrice qui bloque la corrosion.
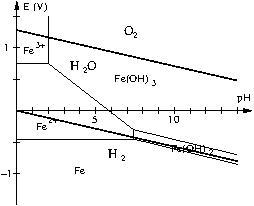
Exemple.
Sur le diagramme suivant, identifier les zones éventuelles d’immunité, de corrosion et de passivation du fer.
Méthode 3. Prévoir une corrosion différentielle.
Entre deux zones distinctes d’une même pièce métallique, les différences de conditions physiques ou chimiques créent une différence de potentiel de Nernst, et apparition d’une micropile électrochimique.
On distingue ainsi
* la corrosion différentielle par hétérogénéité du support : lorsque la pièce métallique est formée de deux métaux distincts, c’est toujours celui de potentiel standard le plus faible qui est oxydé
* la corrosion différentielle par hétérogénéité du milieu : lorsque la pièce métallique possède deux zones où règne une concentration d’oxydant différente, c’est toujours au niveau de celle où cette concentration est la plus faible que l’oxydation a lieu.
Démonstration de cours.
Prouver l’existence d’une corrosion différentielle par hétérogénéité de support.
Méthode 4. Expliquer les modes de protection contre la corrosion.
1. Protection par couche de protection
On bloque les échanges chimiques, approche des espèces oxydantes, évacuation des ions formés, transfert d’électrons.
2. Protection par anode sacrificielle.
On utilise la corrosion différentielle pour protéger un métal ![]() de la corrosion en plaçant un plot de métal
de la corrosion en plaçant un plot de métal ![]() de potentiel inférieur.
de potentiel inférieur.
3. Protection anodique ou cathodique.
* Grâce à un générateur de tension, on impose un potentiel électrique auquel le métal est dans sa zone d’immunité
* Grâce à un générateur de courant, on impose un courant électrique qui impose la réduction des ions métalliques par apport d’électrons, et la reformation du métal.
Exemple.
Pourquoi une couche d’huile forme-t-elle une couche efficace contre la corrosion humide ?
Méthode 5. Calculer une vitesse de corrosion.
1. Lors de la corrosion humide des métaux, l’oxydant est ![]() ou
ou ![]() et le réducteur est le métal
et le réducteur est le métal ![]()
2. On trace les courbes courant potentiel des deux couples
* oxydation anodique (![]() et
et ![]() )
) ![]()
* réduction cathodique (![]() et
et ![]() ) du couple de l’eau.
) du couple de l’eau.
3. On détermine graphiquement le potentiel mixte qu’on appelle le potentiel de corrosion.
4. On détermine graphiquement l’intensité de corrosion ![]() en A ou
en A ou ![]() en
en ![]() , on en déduit la vitesse de corrosion en mol par seconde ou en mole par mètre carré et par seconde.
, on en déduit la vitesse de corrosion en mol par seconde ou en mole par mètre carré et par seconde.
Exemple.
Exprimer la vitesse de disparition de diminution de l’épaisseur du métal, en mètres par seconde en fonction de l’intensité volumique de corrosion ![]() et des autres paramètres pertinents.
et des autres paramètres pertinents.
Ne tardez pas sur vos révisions de concours, plus tôt vous vous préparez, mieux vous réussirez ! Pour cela, utilisez dès maintenant, les cours en ligne de physique-chimie en PSI, mais aussi les cours en ligne de physique-chimie en PT ou encore les cours en ligne de physique-chimie en MP pour maximiser vos connaissances. Concernant la filière PC, les cours en ligne de chimie en PC et les cours en ligne de physique en PC sont aussi consultables gratuitement.
Piles, électrolyseurs, accumulateurs
Méthode 1. Étudier une pile électrochimique
1. On trace les deux demi-courbes courant potentiel.
2. La tension à vide est la différence des potentiels de Nernst.
3. L’intensité de court-circuit est égale à l’intensité de fonctionnement au potentiel mixte.
4. Au fur et à mesure de l’usure de la pile, les potentiels de Nernst ont tendance à se rapprocher, la tension à vide diminue, l’intensité de court-circuit diminue elle-aussi.
Exemple.
Pour une pile ![]()
![]() , où
, où ![]() et
et ![]() sont des métaux qui forment les deux électrodes de la pile, justifier les affirmations du point 4 relatifs à l’usure de la pile.
sont des métaux qui forment les deux électrodes de la pile, justifier les affirmations du point 4 relatifs à l’usure de la pile.
Méthode 2. Étudier un électrolyseur
1. On trace les deux demi-courbes courant potentiel.
2. La tension minimale pour forcer l’électrolyse est la différence des potentiels de Nernst augmentés des éventuelles surtensions cathodique et anodique.
3. L’intensité d’électrolyse à tension ![]() opposée est déterminée graphiquement en cherchant un point sur la courbe anodique et un point sur la courbe cathodique tels que leur différence de potentiel vaut
opposée est déterminée graphiquement en cherchant un point sur la courbe anodique et un point sur la courbe cathodique tels que leur différence de potentiel vaut ![]() et les intensités anodique et cathodique sont opposées.
et les intensités anodique et cathodique sont opposées.
4. On en déduit la puissance consommée par l’électrolyse ![]()
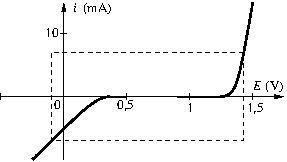
Exemple.
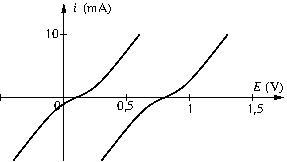
Sur les courbes suivantes, déterminer la tension minimale d’électrolyse et l’intensité d’électrolyse pour une tension ![]()
Méthode 3. Analyser le fonctionnement d’un accumulateur
1. On fait un schéma complet.
2. les couples rédox en présence ont une différence de potentiels de Nernst qui implique
* un sens de fonctionnement spontané, correspondant au fonctionnement en pile
* un sens de fonctionnement qui nécessite une tension électrique, correspondant au fonctionnement en électrolyseur.
3. Pour chaque fonctionnement, on renvoie aux paragraphes précédents (pile et électrolyseur)
4. On complète le schéma en figurant les transferts d’ions, de molécules, d’électrons, et on justifie la réversibilité du fonctionnement.
5. On est souvent amené à proposer des explications pour des irréversibilités expliquant la dégradation de l’accumulateur au fur et à mesure des cycles successifs de fonctionnement.
6. On détermine les durées des cycles de charge et de décharge, et les énergies et puissances mises en œuvre à chaque fois.
Exemple.
Par lecture des courbes ci-dessous, quelle doit être la tension d’alimentation de l’accumulateur pour que la vitesse de décharge en court-circuit soit égale à la vitesse de charge ?
Certains cours de physique-chimie ont besoin d’être travaillés plus que d’autres, ou ont tous simplement besoin d’être complétés. Les cours en ligne gratuits de physique-chimie en Maths Spé sont parfaits pour cela. Effacez toutes vos difficultés en révisant avec ces quelques chapitres au programme de physique-chimie :

