Chapitres physique-chimie en Première
Cours sur les molécules organiques en 1ère
Résumé de cours Exercices et corrigés
Cours en ligne de physique-chimie en Première
Ce cours en ligne de physique chimie en première vous servira pour travailler les molécules organiques. Vous retrouverez notamment les éléments suivants : alcanes, schémas de Lewis, hydrocarbure et squelette carboné, dérivé des alcanes, spectroscopie IR. Si vous souhaitez vous faire accompagner, n’hésitez pas à consulter nos cours de soutien en physique chimie. Nos enseignants à domicile ou en ligne en classe de 1ère pourront vous aider à mieux appréhender ces notions importantes pour la terminale et le supérieur.
Vous pouvez consulter d’autres résumés de cours de physique chimie en première sur notre site : Énergie et réactions chimiques, interaction et champs, statique des fluides, etc.
Alcanes en 1ère
Schémas de Lewis des atomes de base
Les numéros atomiques valent ![]() ,
, ![]() ,
, ![]() et
et ![]()
On en déduit les « schémas de Lewis » des quatre atomes.
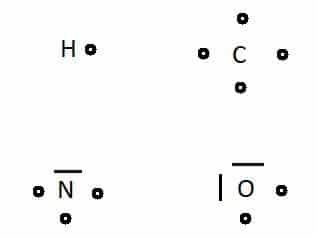
On constate que l’atome de carbone peut former quatre liaisons, l’hydrogène une seule, et accessoirement, l’azote trois et l’oxygène 2.
La description des molécules de chimie organique n’est qu’un jeu de construction, organisé, dans lequel on essaie de former des familles de molécules comportant du carbone, de l’hydrogène d’abord, puis d’éventuels autres atomes, O, N, ou autres.
Exemple : L’atome
Un atome fait partie de la famille des halogènes s’il se trouve sur l’avant-dernière colonne du tableau périodique. Combien de liaison(s) cet atome peut-il former ?
Corrigé de l’exemple :
L’atome halogène X possède un unique électron seul et en l’appariant avec un électron seul d’un autre atome, X aura ainsi la structure électronique du gaz noble le plus proche, celui qui est dans la colonne qui suit, dernière colonne du tableau.
Hydrocarbures et squelette carboné.
Dans un hydrocarbure, on n’a que des atomes de carbone et des atomes d’hydrogène.
Comme un H ne peut faire qu’une liaison, il ne peut assurer la cohésion d’une molécule.
Le principe de construction est donc le suivant : on lie les atomes de carbone puis on apparie tous les électrons restés seuls des différents atomes de C avec autant d’électrons seuls d’hydrogène.
La structure de l’édifice des atomes de carbone s’appelle le squelette.
Alcanes
Alcanes à chaîne linéaire
Un alcane à chaîne linéaire possède une chaîne carbonée de comportant une succession de carbones simplement liés les uns aux autres.
Chaque C est lié à 2 autres C, sauf ceux de bout de chaîne.
Les alcanes sont nommés ainsi
* la racine du mot désigne le nombre d’atomes de carbone de la chaîne, méth- (1), éth- (2), prop- (3), but- (4), etc.
* le suffixe est -ane.
Plutôt que de dessiner complètement le schéma de Lewis, on donne la formule semi-développée en écrivant à côté de chaque C le H muni d’un indice désignant le nombre d’atomes d’hydrogène auxquels ce carbone est lié.
On démontre que la formule brute d’un alcane à chaîne linéaire s’écrit
![]()
où ![]() est le nombre d’atomes de carbone au total.
est le nombre d’atomes de carbone au total.
Alcane à chaîne ramifiée
Retrouvez cette partie de cours sur l’alcane à chaine ramifiée dans notre application mobile gratuite PrepApp à télécharger sur Google play ou Apple store.
Alcane à chaîne cyclique
Cette partie de résumé de cours sur l’alcane à chaine cyclique est à retrouver dans l’appli mobile PrepApp.
Molécules organiques : Dérivés des alcanes
1. Un dérivé d’alcane est une molécule dont le squelette est celui d’un alcane, mais dont un atome d’hydrogène au moins a été remplacé par un groupe caractéristique.
2. Un alcool est un dérivé d’alcane dont le groupe caractéristique est le groupe hydroxyle -OH
On le nomme par
* la racine de l’alcane
* le numéro du carbone qui porte le -OH
* le suffixe -ol
Sa formule brute s’écrit
![]()
3. Le groupe carbonyle est formé par une double liaison C=O
a. Si le carbone qui porte ce groupe est un carbone de bout de chaîne, il est lié à un atome d’hydrogène, la molécule est un aldéhyde.
On le nomme par la racine de l’alcane et le suffixe-al
b. Si le carbone qui porte ce groupe n’est pas un carbone de bout de chaîne, il est relié à deux autres C et à aucun H, la molécule est une cétone.
On la nomme par la racine de l’alcane suivie du numéro du carbone qui porte l’oxygène et par le suffixe -one.
La formule brute commune d’un aldéhyde et d’une cétone comportant ![]() carbones est
carbones est
![]()
4. Le groupe carboxyle est un atome de carbone de bout de chaîne doublement lié à un atome d’oxygène et simplement lié à un autre atome d’oxygène
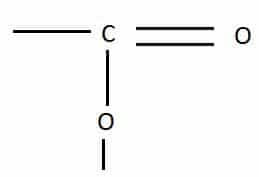
Un acide carboxylique est une molécule dont le squelette est celui d’un alcane, mais dont un carbone de bout de chaîne forme un groupe carboxyle, le second atome d’oxygène étant lié à un hydrogène.
On note parfois ![]() cet acide carboxylique.
cet acide carboxylique.
(C’est un acide car il a tendance à libérer cet atome d’hydrogène en formant un ion hydrogène et un ion carboxylate.)
On le nomme par le terme « acide » suivi de la racine de l’alcane et la terminaison « -oïque »
Sa formule brute s’écrit
![]()
COURS DE CHIMIE
Nous avons sélectionné pour vous les meilleurs profs particuliers.
POUR ACCÉLÉRER MA PROGRESSION EN CHIMIE, JE TROUVE DES
Avis Google France ★★★★★ 4,9 sur 5
Cours sur les molécules organiques : Spectroscopie IR
1. Principe de la spectroscopie IR.
Il n’est pas possible de voir les molécules, mais elles réagissent pourtant aux radiations infrarouges.
Comme on le voit dans le cours sur l’optique en première (couleurs), certaines molécules présentes dans un pigment absorbent des radiations précises, et la couleur perçue est le complémentaire de la couleur absorbée.
C’est la même chose : une assemblée de molécules organiques toutes identiques absorbe certaines radiations dans le domaine des infrarouges (IR en abrégé). L’absorbance du système est grande dans ce cas, donc la transmittance est petite.
Le spectre d’absorption infrarouge (spectre IR en abrégé) est la courbe donnant
La transmittance ![]() , nombre sans dimension compris entre 0 et 1
, nombre sans dimension compris entre 0 et 1
En fonction du nombre d’onde ![]() en
en ![]() , inverse de la longueur d’onde
, inverse de la longueur d’onde ![]() , sur une échelle décroissante, variant en général entre 4000 et
, sur une échelle décroissante, variant en général entre 4000 et ![]()
Consultez les parties de résumés de cours suivantes en téléchargeant notre application mobile PrepApp :
2. Exploitation d’un spectre IR
3. Empreintes digitales
Retrouvez d’autres cours en ligne gratuits en 1ère sur notre site :

