Cours en ligne Physique en Maths Sup
Chapitres Physique en MPSI, PCSI, MP2I, PTSI
Cours de maths sup sur la thermodynamique descriptive
Résumé de Cours Exercices et corrigés
Cours en ligne de Physique en Maths Sup
Ce résumé de cours de Physique porte sur la thermodynamique descriptive, chapitre au programme de Maths Sup. Il vous est donc essentiel de maîtriser à la perfection cette matière en vue des concours des écoles d’ingénieurs, n’hésitez à suivre des cours de physique chimie particulier. En effet, impossible de rater cette manière étant donné son coefficient, comme vous pouvez d’ailleurs le constater sur notre simulateur d’admissibilité pour les prépas scientifiques.
A. Système Thermodynamique en maths sup
1. Pression, volume, température absolue en maths sup
* La pression ![]() d’un système au contact d’une paroi de vecteur surface élémentaire
d’un système au contact d’une paroi de vecteur surface élémentaire ![]() (orthogonal à la surface), subissant de la part du fluide une force pressante
(orthogonal à la surface), subissant de la part du fluide une force pressante ![]() est définie par
est définie par
![]()
![]() est exprimée en pascals (
est exprimée en pascals (![]() )
)
* Le volume ![]() d’un système, exprimé en mètres cube, est celui occupé par les constituants de ce système.
d’un système, exprimé en mètres cube, est celui occupé par les constituants de ce système.
* La température absolue ![]() mesure l’agitation moyenne des constituants, elle est exprimée en kelvins.
mesure l’agitation moyenne des constituants, elle est exprimée en kelvins.
2. Gaz parfait : définition de maths sup
Un gaz parfait vérifie les deux hypothèses :
* (H1) les constituants sont sans interaction
* (H2) la taille des constituants est nulle.
3. État : variable, fonction, équation
* Une variable d’état est une grandeur macroscopique décrivant une propriété microscopique moyenne du système thermodynamique. Elle ne dépend que de l’état instantané du système, et pas de son histoire. Une fonction d’état est une fonction des variables d’état. Une fonction d’état est aussi une variable d’état.
* La température absolue ![]() est une variable d’état universelle pour tous les systèmes thermodynamiques. Un système dans un seul état physique (solide, liquide, gaz) et dont les constituants sont tous identiques est en plus défini par les variables d’état pression
est une variable d’état universelle pour tous les systèmes thermodynamiques. Un système dans un seul état physique (solide, liquide, gaz) et dont les constituants sont tous identiques est en plus défini par les variables d’état pression ![]() et volume
et volume ![]() . * Il existe d’autres variables d’état, comme l’avancement
. * Il existe d’autres variables d’état, comme l’avancement ![]() pour un mélange réactionnel (on l’utilise en thermochimie).
pour un mélange réactionnel (on l’utilise en thermochimie).
* Une variable d’état ![]() est extensive si le système résultant de la juxtaposition de deux sous-systèmes 1 et 2, de valeurs respectives
est extensive si le système résultant de la juxtaposition de deux sous-systèmes 1 et 2, de valeurs respectives ![]() et
et ![]() , a pour valeur
, a pour valeur ![]()
* Une varable d’état ![]() est intensive si le système résultant de la juxtaposition de deux sous-systèmes 1 et 2, de valeurs respectives égales
est intensive si le système résultant de la juxtaposition de deux sous-systèmes 1 et 2, de valeurs respectives égales ![]() , a pour valeur
, a pour valeur ![]()
* Une équation d’état est une relation entre les variables d’état qui caractérisent un système thermodynamique. Un gaz parfait formé de ![]() moles vérifie l’équation d’état
moles vérifie l’équation d’état ![]() avec
avec ![]()
COURS DE PHYSIQUE CHIMIE
Gagner en autonomie avec les meilleurs profs
Des cours de grande qualité
Avis Google France ★★★★★ 4,9 sur 5
B. Énergie Interne en maths sup
1. Énergie interne : définition de maths sup
L’énergie interne ![]() est une fonction d’état d’un système thermodynamique, somme des énergies microscopiques des constituants.
est une fonction d’état d’un système thermodynamique, somme des énergies microscopiques des constituants.
Elle regroupe
* les énergies cinétiques de chaque constituant
* les énergies potentielles de toutes les forces agissant entre les constituants
* d’autres termes constants en général comme l’énergie de masse.
2. Énergie interne d’un système gaz parfait
La première loi de Joule indique que l’énergie interne d’un gaz parfait ne dépend que de la température.
Lorsque celle-ci varie de ![]() à
à ![]() , l’énergie interne varie de
, l’énergie interne varie de
![]()
où ![]() est la capacité thermique à volume constant à la température
est la capacité thermique à volume constant à la température ![]() , exprimée en
, exprimée en ![]()
et ![]() est la capacité thermique molaire à volume constant à la température
est la capacité thermique molaire à volume constant à la température ![]() , exprimée en
, exprimée en ![]()
Pour un gaz parfait monoatomique ![]()
Pour un gaz parfait diatomique à température de l’ordre de 300 K, ![]()
3. Énergie interne d’une phase condensée
Un système en phase condensée, liquide ou solide, est supposée incompressible (![]() est constante) et indilatable (
est constante) et indilatable (![]() est constante).
est constante).
Son énergie interne ne dépend que de la température.
Lorsque celle-ci varie de ![]() à
à ![]() , l’énergie interne varie de
, l’énergie interne varie de
![]()
où ![]() est la capacité thermique à la température
est la capacité thermique à la température ![]() , exprimée en
, exprimée en ![]()
et ![]() est la capacité thermique massique à la température
est la capacité thermique massique à la température ![]() , exprimée en
, exprimée en ![]()
Pour l’eau liquide, ![]()
C. Changement d’état du corps pur en maths sup
1. États et diagramme des phases en Maths Sup
Il existe, de façon très simplifiée, trois états possibles pour un corps pur.
* état solide ordonné et condensé
*état liquide désordonné et condensé
* état gazeux désordonné et dispersé.
Le diagramme des phases indique dans le diagramme (pression, température) les trois domaines schématiques où apparaissent les trois états d’un corps pur, les lignes frontières entre ces états et les noms des 6 transformations qui permettent de passer d’un état à l’autre.
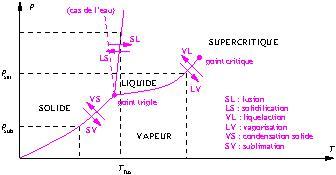
* S ![]() L : fusion
L : fusion
* L ![]() S : solidification
S : solidification
* L ![]() V : vaporisation
V : vaporisation
* V ![]() L : liquéfaction
L : liquéfaction
* S ![]() V : sublimation
V : sublimation
* V ![]() S : condensation.
S : condensation.
Au point triple, les trois états coexistent
Au-dessus du point critique, la distinction entre état liquide et état vapeur disparaît, on a un état fluide dit supercitique.
COURS DE PHYSIQUE-CHIMIE
Nous avons sélectionné pour vous les meilleurs profs particuliers.
POUR ACCÉLÉRER MA PROGRESSION EN PHYSIQUE-CHIMIE, JE TROUVE DES
Avis Google France ★★★★★ 4,9 sur 5
2. Équilibre liquide-vapeur
Lorsqu’on diminue progressivement le volume, à température constante, d’un corps pur à l’état gazeux, le pression augmente.
Lorsqu’on atteint la pression de vapeur saturante à la température ![]() (
(![]() , voir diagramme des phases), le système devient diphasé.
, voir diagramme des phases), le système devient diphasé.
On observe la première goutte de liquide au point de rosée.
Quand on continue de diminuer le volume, la quantité de liquide devient de plus en plus importante, mais la pression reste constante, égale à ![]() : il y a un palier de changement d’état.
: il y a un palier de changement d’état.
Lorsqu’on a la dernière bulle de vapeur, on est au point d’ébullition.
Lorsqu’on n’a plus que du liquide, celui-ci étant très peu compressible, la pression augmente très fortement quand on diminue le volume.
Tout ceci est résumé sur le diagramme de Clapeyron ![]() où
où ![]() est le volume massique.
est le volume massique.
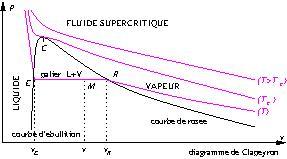
À la température critique, le palier est réduit à un point (le point critique), et au dessus, dans l’état supercritique, on n’a plus de palier.
Le théorème des moments permet de déterminer graphiquement le titre massique en vapeur correspondant à un point M sur le palier
![]()
où ![]() est le volume massique en
est le volume massique en ![]() ,
, ![]() celui du liquide au point d’ébullition, et
celui du liquide au point d’ébullition, et ![]() celui de la vapeur au point de rosée.
celui de la vapeur au point de rosée.
3. Vaporisation et évaporation
Lorsqu’une flaque d’eau s’évapore au Soleil, l’eau n’est pas à ![]()
La pression de vapeur saturante à ![]() vaut pourtant bien
vaut pourtant bien ![]() , pression atmosphérique moyenne.
, pression atmosphérique moyenne.
Mais la pression qu’il faut prendre en compte est la pression partielle de la vapeur d’eau dans l’air.
À la température de l’eau de la flaque, ![]() par exemple, le diagramme des phases indique que la pression de vapeur saturante
par exemple, le diagramme des phases indique que la pression de vapeur saturante ![]() est inférieure à
est inférieure à ![]() .
.
*Si l’air est très humide, et que la pression partielle de l’eau dans l’air est supérieure à ![]() , l’eau de la flaque ne s’évapore pas.
, l’eau de la flaque ne s’évapore pas.
* Si l’air est sec, et que la pression partielle de l’eau dans l’air est inférieure à ![]() , l’eau de la flaque s’évapore.
, l’eau de la flaque s’évapore.
Pour espérer intégrer les meilleures écoles d’ingénieurs de France, réviser sur des cours en ligne de physique de PCSI, MPSI et PTSI peut être très utiles. Assurez-vous d’être au point sur les chapitres suivants :

