Chapitres Physique-Chimie en Terminale Générale
Cours Acides et bases en terminale générale
Résumé de cours Exercices et corrigés
Cours en ligne de Physique-Chimie en Terminale
Pour réussir au baccalauréat, il est essentiel de maîtriser le cours Acide et Bases en terminale générale, quitte à prendre des cours particuliers de Physique-Chimie en cas de blocages. Pour les autres chapitres de Physique-Chimie de terminale, nos cours en ligne de terminale en Physique-Chimie sont disponibles ! Entraînez vous aussi sur nos annales du bac en Terminale et réviser avec des cours particuliers de physique chimie.
A. Acides et bases en terminale
1. L’acide au sens de Brönsted
Un acide au sens de Brönsted est une espèce susceptible de céder un ion hydrogène ![]() selon la réaction
selon la réaction
![]()
Exemple :
Écrire l’équation de la réaction qui prouve que l’acide méthanoïque ![]() est un acide.
est un acide.
Correction :
![]()
2. La formation d’un acide par une espèce
Une espèce forme un acide si elle comporte un atome d’hydrogène lié à un atome plus électronégatif.
Ainsi, dans l’ion ![]() , dont le schéma de Lewis est le suivant.
, dont le schéma de Lewis est le suivant.
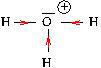
La différence d’électronégativité entre les atomes vaut
![]()
Donc les liaisons O-H sont polarisées, ce qu’on indique par les flèches (dirigées de l’atome le moins électronégatif vers l’atome le plus électronégatif). Le doublet d’électrons est accaparé par l’atome d’hydrogène, ce qui favorise la libération d’un atome d’hydrogène qui abandonnera son unique électron à l’atome d’oxygène, formant ainsi l’ion ![]()
![]()
Exemple :
Prouver que le chlorure d’hydrogène ![]() est un acide et écrire l’équation de la réaction correspondante.
est un acide et écrire l’équation de la réaction correspondante.
On donne ![]() et
et ![]()
Correction :
La différence d’électronégativité vaut
![]()
Donc la liaison entre les deux atomes est polarisée, l’atome de chlore étant nettement plus électronégatif que l’atome d’hydrogène. Il y a donc libération de l’ion hydrogène
![]()
COURS DE PHYSIQUE CHIMIE
Gagner en autonomie avec les meilleurs profs
Des cours de grande qualité
Avis Google France ★★★★★ 4,9 sur 5
3. La base au sens de Brönsted
Une base (au sens de Brönsted) est une espèce chimique susceptible de capturer un ion hydrogène ![]() selon la réaction
selon la réaction
![]()
Exemple :
Écrire l’équation de la transformation qui prouve que l’ammoniac ![]() est une base.
est une base.
Correction :
![]()
4. La possession d’un atome, nécessaire pour former une base
Une espèce forme une base si elle possède un atome (comme l’atome d’oxygène et celui d’azote) comportant au moins un doublet non liant pour combler la lacune de l’ion hydrogène ![]()
Exemple :
Justifier que l’ammoniac ![]() est une base et indiquer sur les schémas de Lewis le doublet non liant de cette molécule et la lacune de l’ion hydrogène.
est une base et indiquer sur les schémas de Lewis le doublet non liant de cette molécule et la lacune de l’ion hydrogène.
Corrigé :
Voici les schémas de Lewis demandés.
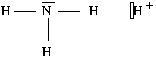
5. L’équation chimique de l’acide
L’équation chimique qui décrit la libération d’un ion hydrogène par un acide, ou sa capture par une base, peut être lue de gauche à droite ou de droite à gauche.
Quand un acide a libéré un ion hydrogène, il devient une base, et lorsqu’une base a capturé un ion hydrogène, elle devient un acide.
On dit que l’acide et la base sont conjugués. On peut écrire indistinctement
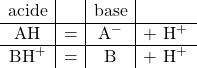
et on note le « couple acide-base » (dans cet ordre, alphabétique)
![]() ou
ou ![]()
6. Les amphotères
Certaines espèces sont à la fois acide et base. On les appelle des espèces amphotères.
Exemple :
L’ion suivant
![]() est un diacide : il peut libérer successivement deux ions hydrogène.
est un diacide : il peut libérer successivement deux ions hydrogène.
a. Traduire les deux libérations consécutives par deux équations chimiques (on supposera que le premier ion qui est libéré est celui lié à un atome d’oxygène).
b. En déduire quelle espèce est amphotère.
Corrigé :
Au niveau du groupement
![]()
on a un comportement acide, comme l’ion ammonium ![]()
Au niveau du groupement
![]()
on a un comportement acide, comme l’acide méthanoïque ![]()
D’après l’énoncé, le premier ion hydrogène cédé est celui du second groupement
![]()
![]()
puis
![]()
![]()
b. L’espèce amphotère est donc
![]()
qui est à la fois base dans la première équation, si on la lit de droite à gauche, et acide dans la seconde.
7. L’eau, un cas particulier important.
C’est un amphotère.
* Elle est une espèce acide car les liaisons O-H sont polarisées (car l’oxygène est nettement plus électronégatif que l’hydrogène) et une molécule d’eau peut donc libérer un ion hydrogène
![]()
L’ion hydroxyde ![]() est donc la base conjuguée de l’eau considérée comme un acide.
est donc la base conjuguée de l’eau considérée comme un acide.
* Elle est une base car l’atome d’oxygène porte deux doublets non liants susceptibles de combler la lacune d’un ion hydrogène
![]()
L’ion oxonium ![]() est donc l’acide conjugué de l’eau considérée comme une base.
est donc l’acide conjugué de l’eau considérée comme une base.
COURS DE CHIMIE
Nous avons sélectionné pour vous les meilleurs profs particuliers.
POUR ACCÉLÉRER MA PROGRESSION EN CHIMIE, JE TROUVE DES
Avis Google France ★★★★★ 4,9 sur 5
B. La réaction acide base en terminale
1. Acide, base et ion hydrogène
Un acide est susceptible de libérer un ion hydrogène, une base d’en capturer un.
Un acide et une base sont donc susceptibles de réagir l’un avec l’autre en s’échangeant un ion hydrogène.
Notons ![]() l’acide,
l’acide, ![]() sa base conjuguée,
sa base conjuguée, ![]() la base et
la base et ![]() son acide conjugué.
son acide conjugué.
L’équation de la réaction s’écrit donc
![]()
Remarquons que l’ion hydrogène a été échangé, et donc n’apparaît pas dans cette équation.
Exemple :
Voici deux couples acide/base
ion ammonium ![]() /ammoniac
/ammoniac ![]()
acide méthanoïque ![]() / ion méthanoate
/ ion méthanoate ![]()
a. Écrire l’équation de la réaction entre l’ion ammonium et l’ion méthanoate.
b. Écrire l’équation de la réaction entre l’ammoniac et l’acide méthanoïque.
c. Que remarque-t-on ?
Correction :
a. ![]()
b. ![]()
c. Les deux réactions sont inverses l’une de l’autre. On verra dans un chapitre ultérieur que l’une est plus favorable que l’autre.
2. Réaction entre une base et l’ion oxonium.
Dans une solution aqueuse d’acide chlorhydrique, par exemple, on trouve des ions oxonium ![]() et des ions chlorure
et des ions chlorure ![]() . Lorsqu’on y introduit une espèce basique en solution aqueuse
. Lorsqu’on y introduit une espèce basique en solution aqueuse ![]() , d’acide conjugué
, d’acide conjugué ![]() , une réaction acide-base se produit
, une réaction acide-base se produit
![]()
Exemple :
Écrire l’équation de la réaction qui se produit quand on mélange une solution d’acide chlorhydrique et une solution d’ammoniaque (ammoniac ![]() en solution aqueuse).
en solution aqueuse).
Corrigé :
![]()
3. Réaction entre un acide et l’ion hydroxyde.
Dans une solution aqueuse d’hydroxyde de sodium (ou soude), on trouve des ions hydroxyde ![]() et des ions sodium
et des ions sodium ![]() . Lorsqu’on y introduit une espèce acide en solution aqueuse
. Lorsqu’on y introduit une espèce acide en solution aqueuse ![]() , de base conjuguée
, de base conjuguée ![]() , une réaction acide-base se produit
, une réaction acide-base se produit
![]()
Exemple :
Écrire l’équation de la réaction qui se produit quand on mélange une solution d’hydroxyde de sodium et une solution d’acide méthanoïque (![]() en solution aqueuse).
en solution aqueuse).
Correction :
![]()
COURS PARTICULIERS EN LIGNE
Nous avons sélectionné pour vous les meilleurs professeurs particuliers.
POUR ACCÉLÉRER MA PROGRESSION
Avis Google France ★★★★★ 4,9 sur 5
Retrouvez toutes les annales du bac de physique-chimie sur les Acides et Bases comme sur le reste du programme de terminale de Physique-Chimie. Vous pourrez le constater sur notre simulateur du Bac : la Physique, avec son fort coefficient, est essentielle pour viser la mention et plus important encore, pour viser le top du classement des prépa MP ou PC une fois les résultats du Bac tombés.
Jetez également un œil aux futurs chapitres de physique-chimie au programme de terminale, dont :
- Les mesures physiques en chimie : Cours en terminale
- Le titrage : Cours en physique chimie
- Cours : Cinétique chimique
- Cours terminale : évolution spontanée d’un système chimique
- Cours physique chimie : mécanismes réactionnels
- Exercices acides bases en terminale
- Exercices et corrigés sur les mesures physiques en terminale

