Chapitres Physique-Chimie en Terminale Générale
Cours Cinétique Chimique Terminale générale
Résumé de cours Exercices et corrigés
Cours en ligne de Physique-Chimie en Terminale
Retrouvez tous nos autres cours en ligne de terminale. En Physique-Chimie de Terminale notamment, votre progression sera fortement accentuée en prenant un prof particulier de physique chimie à domicile ou en suivant des stages intensifs de révision. Ce gain de confiance vous permettra de viser peut être des prépas scientifiques, le top du classement des prépas PC.
A. Suivi cinétique d’une réaction chimique en Terminale
1. Les méthodes de suivi cinétique chimique en Terminale
Ces méthodes permettent de déterminer l’évolution au cours du temps de la concentration d’une espèce ![]() en fonction du temps.
en fonction du temps.
On distingue :
- la conductimétrie où la mesure physique de la conductivité
 permet de déterminer, grâce à la loi de Kolrausch, la concentration d’une espèce ionique
permet de déterminer, grâce à la loi de Kolrausch, la concentration d’une espèce ionique - la spectrophotométrie où la mesure de l’absorbance
 permet de déterminer, grâce à la courbe d’étalonnage (loi de Beer-Lambert) la concentration d’une espèce colorée
permet de déterminer, grâce à la courbe d’étalonnage (loi de Beer-Lambert) la concentration d’une espèce colorée - le titrage où on prélève, à intervalle de temps réguliers, un échantillon de la solution, où on bloque la réaction grâce à une trempe (refroidissement et/ou dilution importante) puis le dosage d’une espèce
2. Le temps de demi-réaction en Terminale
C’est la date à laquelle l’avancement est égal à la moitié de sa valeur finale. Pour une réaction donnée, avec des quantités de réactifs données, plus le temps de demi-réaction est petit, plus la réaction est rapide.
3. La vitesse volumique de disparition en Terminale
La vitesse volumique de disparition d’un réactif ![]() est l’opposé de la dérivée par rapport au temps de sa concentration
est l’opposé de la dérivée par rapport au temps de sa concentration ![]()
![]()
On la détermine graphiquement :
- on trace la tangente à la courbe d’évolution de
![Rendered by QuickLaTeX.com [X]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2022%2018%22%3E%3C/svg%3E) en fonction de
en fonction de 
- on identifie deux points A et B assez éloignés sur cette droite
- on calcule le coefficient directeur de la droite
![]()
* la vitesse volumique de disparition est l’opposée de ce coefficient directeur.
Plus cette vitesse est grande, à concentration de réactifs donnée, plus la réaction est rapide.
4. La vitesse volumique d’apparition en Terminale
La vitesse volumique d’apparition d’un produit ![]() est la dérivée par rapport au temps de sa concentration
est la dérivée par rapport au temps de sa concentration ![]()
![]()
On la détermine graphiquement :
- on trace la tangente à la courbe d’évolution de
![Rendered by QuickLaTeX.com [X]](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%2022%2018%22%3E%3C/svg%3E) en fonction de
en fonction de 
- on identifie deux points A et B assez éloignés sur cette droite
- la vitesse volumique d’apparition est égale au coefficient directeur de cette droite
![]()
Plus cette vitesse est grande, à concentration de réactifs donnée, plus la réaction est rapide.
COURS DE PHYSIQUE-CHIMIE
Nous avons sélectionné pour vous les meilleurs profs particuliers.
POUR ACCÉLÉRER MA PROGRESSION EN PHYSIQUE-CHIMIE, JE TROUVE DES
Avis Google France ★★★★★ 4,9 sur 5
B. Facteurs cinétiques en Terminale générale
1. Définition d’un facteur cinétique en Terminale
Un facteur cinétique est un paramètre qui, pour une réaction donnée, permet d’influer sur sa cinétique (vitesse volumique d’apparition ou de disparition, temps de demi-réaction).
2. La température, un facteur cinétique en Terminale
La température est un facteur cinétique : plus elle est grande, plus la réaction est rapide (augmentation des vitesses volumiques, diminution du temps de demi-réaction).
3. La concentration des réactifs, un facteur cinétique en Terminale
La concentration des réactifs est un facteur cinétique : plus elle est grande, plus la réaction est rapide.
C. Catalyse en Physique-Chimie en Terminale
Un catalyseur est une espèce chimique qui, mise au contact des réactifs, accélère la réaction chimique sans en changer le bilan.
Le catalyseur n’apparaît pas dans l’équation bilan de la réaction chimique.
Il intervient pourtant dans le mécanisme de la réaction, il est consommé puis régénéré.
On distingue la catalyse :
- homogène, où le catalyseur est sous la même état (en général en solution aqueuse) que les réactifs
- hétérogène, où le catalyseur est sous un état différent (souvent solide) que les réactifs
COURS DE CHIMIE
Une équipe pédagogique à l’écoute des familles
Planifiez votre premier cours en quelques minutes
Avis Google France ★★★★★ 4,9 sur 5
D. Réaction d’ordre 1 en Terminale Générale
1. Une réaction en cinétique chimique en Terminale
![]()
a une loi cinétique d’ordre 1 si la vitesse volumique de disparition du réactif A est proportionnelle à la concentration en ce réactif, à toute date ![]()
![]()
![]() est appelée la constante de vitesse
est appelée la constante de vitesse
2. La concentration du réactif en Terminale
La concentration du réactif d’une réaction d’ordre 1 vérifie une équation différentielle linéaire d’ordre 1
![]()
Soit ![]()
SI on note ![]()
La concentration à l’instant initial, alors on démontre en mathématiques que
![]()
La courbe représentative de cette fonction est donnée ci-dessous.
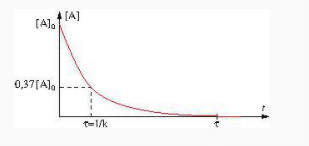
L’inverse de la constante de temps est un temps caractéristique (tau)
![]()
À la date ![]() ,
, ![]() et on retrouve bien
et on retrouve bien ![]()
À la date ![]() ,
, ![]() et
et
![]()
Pour ![]() ,
, ![]()
3. Preuve avec un tableau de données de suivi cinétique
Pour prouver, à partir d’un tableau de données de suivi cinétique, qu’une réaction est d’ordre 1, on trace
![]() en fonction de
en fonction de ![]() .
.
Si c’est une droite, de coefficient directeur ![]() , alors
, alors
![]()
donc ![]()
Ce qui prouve que la réaction est d’ordre 1 et que ![]() est la constante de vitesse.
est la constante de vitesse.
COURS PARTICULIERS EN LIGNE
Nous avons sélectionné pour vous les meilleurs professeurs particuliers.
POUR ACCÉLÉRER MA PROGRESSION
Avis Google France ★★★★★ 4,9 sur 5
Vous le voyez aisément sur notre simulateur du bac : la Physique-Chimie en Terminale a un fort coefficient au Bac. Il est donc essentiel de la réussir pour ne pas être déçu au moment du résultat du bac. Travaillez donc autant que possible sur les annales du bac de physique-chimie, ainsi que sur toutes les autres annales du Bac en Terminale pour les autres matières.
Maintenez-vous à un bon niveau en utilisant divers cours en ligne de physique-chimie de terminale tout au long de l’année, entre autre :
- Cours sur l’évolution spontanée d’un système chimique
- Cours sur les mécanismes réactionnelS bac
- Cours en terminale sur les piles
- Cours en physique chimie : les forces des acides et des bases
- Cours sur l’évolution forcée d’un système chimique
- Exercices corrigés type bac cinétique chimique
- Exercices sur l’équilibre chimique niveau bac

