Chapitres Physique-Chimie en Terminale Générale
Exercices Cinétique Chimique en terminale générale
Résumé de cours Exercices et corrigés
Cours en ligne de Physique-Chimie en Terminale
Entraînez vous autant que possible sur des exercices corrigés pour réussir en terminale en physique, et en cas de blocage tournez vous vers des cours particuliers de physique chimie. En effet les cours particuliers à domicile sont souvent utiles en cas de lacunes, pour éviter les déceptions le jour des résultats du bac. La progression dans cette matière au fort coefficient au bac peut être telle que vous pourrez ensuite viser les meilleures prépas du classement des prépa PC ou MP.
QCM sur la cinétique chimique en Terminale
1) Pour déterminer un temps de demi-réaction par suivi colorimétrique d’une réaction chimique lente où un réactif A est une espèce colorée :
a. on mesure la date ![]() de disparition de la couleur et
de disparition de la couleur et ![]()
b. on prépare un tube à essais témoin dans lequel ![]() où
où ![]() est la concentration initiale de A et
est la concentration initiale de A et ![]() est la date à laquelle le tube à essais dans lequel se déroule la réaction a la même teinte que le tube témoin
est la date à laquelle le tube à essais dans lequel se déroule la réaction a la même teinte que le tube témoin
c. on introduit le mélange réactionnel dans une cuve de spectrophotomètre et ![]() est la date à laquelle l’absorbance est égale à la moitié de l’absorbance initiale.
est la date à laquelle l’absorbance est égale à la moitié de l’absorbance initiale.
2) Lors du suivi cinétique d’une réaction par titrage, on prélève un échantillon et on opère une trempe, en versant l’échantillon dans un volume important d’eau distillée glacée, pour bloquer la réaction le temps du titrage.
Le(s) facteur(s) cinétique(s) impliqué(s) est (sont)
a. la température
b. la concentration des réactifs
c. la concentration des produits
3) Dans la réaction
![]()
![]()
L’ion hydrogène est un catalyseur de l’oxydation de l’ion fer II par l’ion permanganate.
Vrai ou Faux ?
4) L’équation différentielle vérifiée par la concentration ![]() du réactif dans une réaction d’ordre 1 s’écrit
du réactif dans une réaction d’ordre 1 s’écrit
a. ![]()
b. ![]()
c. ![]()
d. ![]()
Correction QCM sur la cinétique chimique en Terminale
1) Réponses B et C :
Le temps de demi-réaction n’est pas la moitié du temps de réaction, mais la date à laquelle la concentration vaut
![]()
2) Réponses A et B: La concentration des produits n’est pas un facteur cinétique.
3) Réponse : Faux. L’ion ![]() est un réactif qui est consommé par la réaction, ce n’est donc pas un catalyseur.
est un réactif qui est consommé par la réaction, ce n’est donc pas un catalyseur.
4) Réponse : A.
Par définition
![]() soit
soit
![]()
COURS DE PHYSIQUE-CHIMIE
Nous avons sélectionné pour vous les meilleurs profs particuliers.
POUR ACCÉLÉRER MA PROGRESSION EN PHYSIQUE-CHIMIE, JE TROUVE DES
Avis Google France ★★★★★ 4,9 sur 5
Exercices sur la Cinétique Chimique en Physique-Chimie
Exercice 1 : suivi cinétique par échelle de teinte
L’ion iodure et l’ion peroxodisulfate réagissent selon une réaction totale d’équation
![]()
On prépare dix béchers de 200 mL de solutions où la concentration en diiode vaut respectivement
0,010 ; 0,020 ; … ; 0,090 ; 0,100 moles par litre.
Le diiode est la seule espèce, parmi celles impliquées ici, qui donne une teinte, brun-orangée, à la solution, on a ainsi réalisé une échelle de teinte.
On introduit dans un bécher ![]() d’une solution de pexoxodisulfate de potassium de concentration
d’une solution de pexoxodisulfate de potassium de concentration
![]()
À l’instant initial ![]() , on verse dans le bécher
, on verse dans le bécher ![]() d’une solution d’iodure de potassium de concentration
d’une solution d’iodure de potassium de concentration
![]() .
.
On mesure les durées séparant le passage de la teinte de la solution d’une valeur à la suivante dans l’échelle de teintes.
On mesure ainsi
- la durée séparant l’instant initial et l’instant où la teinte est la même que dans le bécher où la concentration vaut

![]()
- puis celle séparant le passage de la teinte correspondant à
 jusqu’à celle correspondant à
jusqu’à celle correspondant à 
![]()
- et ainsi de suite
![]() ,
, ![]() ,
, ![]() ,
,
![]() ,
, ![]() ,
, ![]() ,
,
![]() ,
, ![]()
Questions :
a. Calculer les concentrations initiales dans le bécher
![]() et
et ![]()
b. Prouver, grâce à un tableau d’avancement, que les réactifs sont introduits dans les proportions stœchiométriques, calculer la quantité de matière finale de diiode dans le bécher et en déduire sa concentration finale.
c. Expliquer comment construire le tableau donnant ![]() en fonction de la date
en fonction de la date ![]()
d. Quelle est la durée de la transformation ?
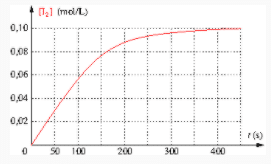
e. Le graphique donnant cette concentration en fonction de la date est donné ci-dessous. Déterminer le temps de demi-réaction et la vitesse volumique d’apparition du diiode à l’instant initial.
Exercice 2 : facteurs cinétiques
La formation de la rouille est réalisée en mettant du fer métallique au contact de l’eau aérée, c’est-à-dire contenant du dioxygène en solution
![]()
On constate que la formation de la rouille est plus rapide
a. quand on augmente la température
b. quand on aère plus fortement l’eau, grâce à un bulleur
c. quand on agite
d. quand on passe, à masse égale, d’un clou en fer à de la limaille de fer.
Identifier les facteurs cinétiques et proposer une explication à l’échelle microscopique.
Exercice 3 : mise en évidence de la catalyse
L’eau oxygénée ![]() se décompose spontanément en eau liquide et en dioxygène gazeux.
se décompose spontanément en eau liquide et en dioxygène gazeux.
Le temps de demi-réaction est de l’ordre de l’heure.
Quand on verse quelques gouttes de chlorure de fer III, orange, dans la solution, on voit une vive effervescence, la solution devient marron-vert, couleur caractéristique des ions fer II, puis l’effervescence disparaît et la solution devient orangée.
Expliquer ce qui s’est passé, et en quoi l’ion fer III agit en catalyseur.
Exercice 4 : réaction d’ordre 1
La décomposition spontanée d’un composé oxygéné s’écrit
![]()
C’est une réaction d’ordre 1, de constante de vitesse ![]()
On rappelle que

- la dérivée de la fonction définie par
 est
est 
- pour
 réel strictement positif et
réel strictement positif et  réel quelconque
réel quelconque
![]()
a. À quelle condition un suivi conductimétrique de la cinétique de cette réaction est-il possible ?
b. Établir l’équation différentielle vérifiée par ![]()
c. On note ![]() la concentration du réactif à l’instant initial.
la concentration du réactif à l’instant initial.
Vérifier que ![]() est la solution de l’équation différentielle qui vérifie la condition initiale.
est la solution de l’équation différentielle qui vérifie la condition initiale.
d. Exprimer le temps de demi-réaction en fonction de ![]() . Calculer sa valeur
. Calculer sa valeur ![]()
COURS DE CHIMIE
Nous avons sélectionné pour vous les meilleurs profs particuliers.
POUR ACCÉLÉRER MA PROGRESSION EN CHIMIE, JE TROUVE DES
Avis Google France ★★★★★ 4,9 sur 5
Correction des exercices sur la Cinétique Chimique
Correction de l’exercice suivi cinétique par échelle de teinte
a. Le volume total de la solution vaut
![]()
Les quantités de matière introduites valent
![]()
![]()
On en déduit
![]()
![]()
![]()
![]()
b. On dresse le TA en utilisant les quantités de matière introduites calculées à la question a.
La réaction étant totale, ![]() et on obtient la même valeur pour les deux réactifs
et on obtient la même valeur pour les deux réactifs
![]() donne
donne ![]()
![]() donne
donne ![]()
Les réactifs sont donc introduits en proportions stœchiométriques.
Dans l’état final, le TA indique qu’on obtient
![]() de diiode donc
de diiode donc
![]()
c. La date à laquelle on atteint une concentration donnée en diiode, par exemple ![]() , est la somme des durées
, est la somme des durées
![]()
On en déduit les dix dates pour chaque concentration de l’échelle de teinte.
d. La réaction est terminée quand
![]()
Donc à la date ![]()
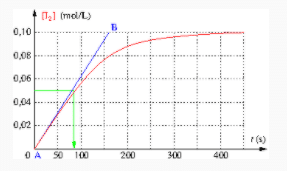
e. Le temps de demi-réaction est la date à laquelle
![]()
On repère sur le graphique que cette valeur est atteinte à la date
![]()
On trace la tangente à la courbe au point initial.
On repère deux points sur cette droite
![]() et
et ![]()
On en déduit
![]()
![]()
Correction de l’exercice sur les facteurs cinétiques
a. La température est un facteur cinétique, plus elle est grande, plus l’agitation des molécules de dioxygène en solution est grande, plus celles-ci se trouvent souvent, en une durée donnée, au contact du fer, plus elles ont de chances d’oxyder les atomes de fer.
b. La concentration des réactifs (le dioxygène en solution ici) est un facteur cinétique : plus on aère l’eau, plus la concentration ![]() est grande, plus le nombre de contacts, en une durée donnée, entre des molécules de dioxygène et des atomes de fer est grand, plus le nombre d’oxydations est grand.
est grande, plus le nombre de contacts, en une durée donnée, entre des molécules de dioxygène et des atomes de fer est grand, plus le nombre d’oxydations est grand.
c. L’agitation est un facteur cinétique : plus elle est grande, plus le nombre de contacts, en une durée donnée, entre des molécules de dioxygène et des atomes de fer est grand, plus le nombre d’oxydations est grand.
d. La surface de contact est un facteur cinétique : plus la division du fer est grande, plus la surface de contact entre les atomes de fer et les molécules de dioxygène est grande, plus le nombre de contacts, en une durée donnée, entre des molécules de dioxygène et des atomes de fer est grand, plus le nombre d’oxydations est grand.
Correction de l’exercice sur la mise en évidence de la catalyse
Un catalyseur accélère la réaction :
C’est le cas car l’effervescence prouve le dégagement important de dioxygène gazeux, donc la nette accélération de la réaction.
Un catalyseur réagit dans un premier temps : c’est le cas car l’ion fer II (orange) est réduit en fer II (marron-vert).
Un catalyseur est régénéré en fin de réaction : c’est le cas car la couleur marron-vert disparaît et la couleur orange finale prouve que l’ion fer
III a été reformé.
Il s’agit d’une catalyse homogène car le réactif (![]() ) et le catalyseur (
) et le catalyseur (![]() ) sont tous deux en phase aqueuse.
) sont tous deux en phase aqueuse.
COURS PARTICULIERS EN LIGNE
Nous avons sélectionné pour vous les meilleurs professeurs particuliers.
POUR ACCÉLÉRER MA PROGRESSION
Avis Google France ★★★★★ 4,9 sur 5
Correction de l’exercice réaction d’ordre 1
a. D’après la loi de Kolrausch, la conductivité de la solution vaut
![]()
![]()
Où ![]() désigne la conductivité molaire ionique.
désigne la conductivité molaire ionique.
En notant ![]() la quantité de matière initiale du réactif,
la quantité de matière initiale du réactif, ![]() le volume de la solution et
le volume de la solution et ![]() l’avancement à la date
l’avancement à la date ![]() , un tableau d’avancement prouve que
, un tableau d’avancement prouve que
![]()
![]()
On en déduit que
![]()
![]()
Cette conductivité dépend du temps si et seulement si
![]()
Le suivi conductimétrique n’est donc possible que si les conductivités des deux espèces ioniques sont distinctes.
b. Par définition (voir cours) d’une réaction d’ordre 1
![]()
Soit, par définition de la vitesse volumique de disparition
![]()
Soit enfin
![]()
c. On exprime la dérivée de la fonction proposée
![]()
![]()
donc l’équation différentielle est bien vérifiée.
À ![]() , on a
, on a
![]()
Donc la condition initiale est bien vérifiée.
d. Par définition du temps de demi-réaction
![]()
donc ![]()
donc ![]()
Or ![]()
donc ![]()
Retrouvez toutes les annales du bac de physique-chimie pour bien vous entraîner sur la Cinétique Chimique et maîtriser le programme de terminale de Physique-Chimie en général. Utilisez aussi notre simulateur du bac pour voir où gagner un maximum de points et déterminer vos priorités pour l’organisation de votre travail. Vous pourrez ainsi très certainement viser la mention !
Ne restez pas sur vos acquis et révisez dès maintenant les futurs chapitres du programme de physique-chimie de terminale, notamment :
- Exercice sur l’évolution spontanée d’un système chimique
- Exercice sur les mécanismes réactionnels
- Exercices sur les piles type bac
- Exercice et corrigé sur les forces des acides et des bases
- Exercice sur l’évolution forcée d’un système chimique
- Cours sur la cinétique chimique terminale
- Résumé de cours sur l’équilibre chimique en terminale

