Chapitres Physique-Chimie en Terminale Générale
Exercices Equilibre Chimique en Terminale Générale
Résumé de cours Exercices et corrigés
Cours en ligne de Physique-Chimie en Terminale
Travaillez sur nos exercices sur l’équilibre Chimique en Terminale afin de maîtriser ce chapitre du programme de physique chimie de Terminale sur le bout des doigts. Vous avez également la possibilité de vous entraîner sur les annales du bac de physique chimie. Toutefois, si cela ne suffit pas et que vous ne parvenez pas à faire face à vos lacunes, vous pourrez progresser efficacement et rapidement grâce à des cours de physique chimie.
QCM sur l’Équilibre Chimique en Terminale
1. Dans un équilibre chimique,
a. les réactifs et les produits sont figés
b. les réactifs et les produits se transforment les uns en les autres en permanence
2. La seule réaction chimique entre les espèces A, B, C et D en solution aqueuse est
![]()
Si on introduit dans un bécher un mélange de C et de D en solution aqueuse :
a. il ne se passe rien
b. l’un des deux, en défaut, disparaît
c. A et B apparaissent, et il reste toujours C et D
Correction du QCM sur l’Équilibre Chimique en Terminale
Correction 1 :
réponse B : les réactifs et les produits se transforment les uns en les autres en permanence
À l’équilibre, la vitesse de disparition de chaque espèce est égale à celle de formation.
Correction 2 :
réponse C : A et B apparaissent, et il reste toujours C et D
L’équilibre est dans les deux sens, C et D réagissent et à l’équilibre, on a coexistence des 4 espèces.
Tu veux réussir en chimie ?
Développe ton autonomie et gagne en méthodologie
Des cours dynamiques et non magistraux
Anticipe les notions et les échéances à venir en chimie
Confiez-nous votre besoin et définissons ensemble le professeur idéal en chimie pour votre enfant
Avis Google France
★★★★★ 4,9 sur 5
Exercices sur l’équilibre chimique en terminale générale
Exercice 1 : Solubilité avec stœchiométrie compliquée
Un sel solide se dissocie dans l’eau selon la réaction
![]()
La constante de cet équilibre vaut ![]()
La masse molaire du sel vaut
![]()
On introduit du sel dans un litre d’eau jusqu’à atteindre la saturation, c’est-à-dire jusqu’au moment où le cristal de sel introduit en plus ne se dissocie pas.
On note ![]() la masse de sel correspondante.
la masse de sel correspondante.
a. Pourquoi l’état atteint est-il un état d’équilibre ?
b. Construire un tableau d’avancement et en déduire les concentrations ![]() et
et ![]() en fonction de
en fonction de ![]() .
.
c. En déduire la valeur de ![]() à la saturation.
à la saturation.
Exercice 2 : Déplacement d’équilibre en Terminale
Un équilibre chimique a pour équation
![]()
Sa constante d’équilibre vaut ![]() où
où ![]() désigne la température.
désigne la température.
On introduit dans un litre d’eau des quantités de matière égales de A et de B.
a. Quel est le quotient de réaction à l’état initial ? Pourquoi C se forme-t-il ? On laisse la réaction évoluer jusqu’à l’équilibre chimique.
b. À partir de l’état d’équilibre de la question a, on introduit rapidement une petite quantité de A dans la solution. Dans quel sens la réaction évolue-t-elle ?
c. À partir de l’état d’équilibre de la question a, on introduit rapidement une petite quantité de C dans la solution. Dans quel sens la réaction évolue-t-elle ?
d. On suppose que ![]() est une fonction croissante de la température
est une fonction croissante de la température ![]() . À partir de l’état d’équilibre de la question a, doit-on chauffer ou refroidir le mélange pour favoriser la formation de l’espèce C ?
. À partir de l’état d’équilibre de la question a, doit-on chauffer ou refroidir le mélange pour favoriser la formation de l’espèce C ?
Correction des exercices sur l’Équilibre Chimique
Correction de l’exercice 1 sur la solubilité avec stœchiométrie
a. Dans l’état de solution saturée, il y a coexistence du réactif et des deux produits, ce qui correspond à un équilibre.
b. On construit le TA en posant ![]()
Comme dans l’état final d’équilibre, il n’y a qu’un cristal de sel solide, ![]()
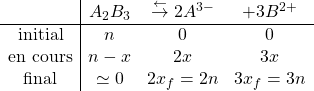
On en déduit (avec ![]() )
)
![]()
![]()
c. À l’équilibre, le quotient de réaction est égal à la constante de réaction donc
![]()
soit ![]()
donc ![]()
Correction de l’exercice 2 sur le déplacement d’équilibre en terminale :
a. À l’instant initial, ![]() donc
donc
![]()
La réaction évolue dans le sens tel que ![]() s’approche de
s’approche de ![]() .
.
Comme ici, ![]() , la réaction évolue dans le sens de croissance de
, la réaction évolue dans le sens de croissance de ![]() , donc dans le sens direct permettant d’augmenter
, donc dans le sens direct permettant d’augmenter ![]() au numérateur et de diminuer
au numérateur et de diminuer ![]() et
et ![]() au dénominateur. Il y a donc formation de C.
au dénominateur. Il y a donc formation de C.
b. À l’équilibre, ![]() .
.
En ajoutant rapidement une petite quantité de A, on augmente la valeur de ![]() qui est au dénominateur, donc on diminue
qui est au dénominateur, donc on diminue ![]() .
. ![]() se retrouve ainsi inférieur à
se retrouve ainsi inférieur à ![]() , donc la réaction évolue dans le sens direct, pour faire réaugmenter
, donc la réaction évolue dans le sens direct, pour faire réaugmenter ![]() .
.
c. À l’équilibre, ![]() .
.
En ajoutant rapidement une petite quantité de C, on augmente la valeur de ![]() qui est au numérateur, donc on augmente
qui est au numérateur, donc on augmente ![]() .
. ![]() se retrouve ainsi supérieur à
se retrouve ainsi supérieur à ![]() , donc la réaction évolue dans le sens rétrograde pour faire rediminuer
, donc la réaction évolue dans le sens rétrograde pour faire rediminuer ![]() .
.
d. On veut favoriser la formation de C, donc forcer la réaction à évoluer dans le sens direct.
À partir de l’état d’équilibre, où ![]() , on veut donc changer la température de
, on veut donc changer la température de ![]() à
à ![]() , de telle sorte que
, de telle sorte que ![]() . 4
. 4
On doit donc provoquer l’augmentation de la constante d’équilibre. Or ![]() est une fonction croissante de la température. On doit donc augmenter la température (
est une fonction croissante de la température. On doit donc augmenter la température (![]() ).
).
Tu veux réussir en physique chimie ?
Accède aux meilleurs exercices et résumés de cours
Travaille sur les annales en autonomie
Fais toi accompagner en cours à domicile
Les élèves que nous aidons en cours de physique -chimie à domicile recommandent à 98% nos profs
Avis Google France
★★★★★ 4,9 sur 5
En vous entraînant avec assiduité sur des exercices de Physique-Chimie, vous pourrez progresser jusqu’à être serein le jour des résultats du Bac. En effet, maîtriser la Physique-Chimie est un gage de réussite, car le coefficient au Bac de cette spécialité est très élevé. À l’inverse, accumuler des lacunes dessus peut être très préjudiciable. Il peut être alors nécessaire de se tourner vers des cours particuliers afin de remédier à ces difficultés passagères. Et entre 2 cours particuliers, les élèves pourront revoir à leur rythme ou prendre de l’avance sur le programme de terminale avec les cours en ligne de physique-chimie gratuits, entre autres :
- Exercices corrigés sur les mécanismes réactionnels en terminale
- Exercices corrigés sur les piles bac
- Exercices et corrigés sur la force des acides et des bases en terminale
- Exercices : l’évolution forcée d’un système chimique
- Exercices corrigés type bac sur la radioactivité
- Cours sur l’équilibre chimique en terminale
- Résumé de cours mécanisme réactionnel en terminale

