Chapitres Physique-Chimie en Terminale Générale
Exercices Mesures Physiques en terminale générale
Résumé de cours Exercices et corrigés
Cours en ligne de Physique-Chimie en Terminale
Il est important de bien s’entraîner sur des exercices corrigés pour réussir la physique en terminale. Vous appliquez ainsi vos connaissances acquises en cours physique chimie. Les cours particuliers à domicile sont souvent utiles pour vous débloquer sur les notions les plus complexes. Vous pourrez ainsi maîtriser au mieux le programme de terminale et notamment le programme de terminale de Physique-Chimie, particulièrement essentiel du fait du fort coefficient au bac de la matière.
QCM sur la pH-métrie en Terminale
1. Le pH mesure
a. la quantité d’espèces acides dans une solution
b. l’acidité d’une solution
2. L’introduction dans de l’eau pure d’une petite quantité d’espèces acides
a. augmente le pH
b. diminue le pH
3. La concentration en ions oxonium vaut ![]() (à faire sans calculatrice)
(à faire sans calculatrice)
Le pH est
a. inférieur à 4
b. compris entre 4 et 5
c. supérieur à 5
COURS DE PHYSIQUE-CHIMIE
Nous avons sélectionné pour vous les meilleurs profs particuliers.
POUR ACCÉLÉRER MA PROGRESSION EN PHYSIQUE-CHIMIE, JE TROUVE DES
Avis Google France ★★★★★ 4,9 sur 5
Correction du QCM sur pH-métrie
Correction 1 : réponse B
Correction 2 : réponse B
Les espèces acides libèrent des ions hydrogène qui se fixent sur des molécules d’eau pour former des ions oxonium ![]()
La concentration ![]() augmente, son logarithme (divisé par
augmente, son logarithme (divisé par ![]() ) augmente et son opposé, le pH, diminue.
) augmente et son opposé, le pH, diminue.
Correction 3 : réponse B
On a
![]()
donc
![]()
donc
![]()
QCM sur la Spectroscopie en Terminale
1. Un spectre UV peut donner
a. l’absorbance en fonction de ![]()
b. l’absorbance en fonction de ![]()
c. la transmittance en fonction de ![]()
d. la transmittance en fonction de ![]()
2. Voici un spectre visible d’une solution.
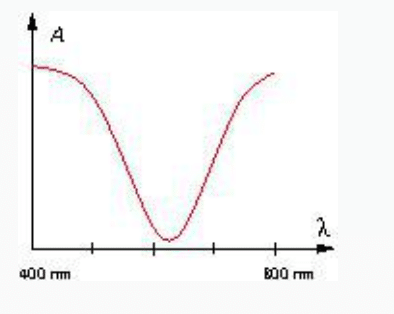
La solution paraît
a. rouge
b. jaune
c. magenta (mélange de bleu et de rouge)
d. incolore
Correction du QCM sur la Spectroscopie
Correction 1 : réponse A
* Pour les spectres UV-visible, on représente l’absorbance, pour les spectres IR, c’est la transmittance
* ![]() est un intervalle dans les UV
est un intervalle dans les UV
* ![]() est un intervalle dans les IR
est un intervalle dans les IR
Correction 2 : réponse B
L’absorbance est minimale pour le milieu du spectre visible, le jaune.
Elle absorbe le bleu et le rouge, et laisse passer le jaune, elle apparaît donc jaune.
QCM sur la Conductimétrie en Terminale
1. On note ![]() la conductance et
la conductance et ![]() la conductivité
la conductivité
a. ![]() et
et ![]() ont la même unité
ont la même unité
b. ![]() est en S et
est en S et ![]() en
en ![]()
c. ![]() est en S et
est en S et ![]() en
en ![]()
d. ![]() est en S et
est en S et ![]() en
en ![]()
2. On introduit du chlorure de sodium (![]() ) dans de l’eau pure
) dans de l’eau pure
a. On peut déterminer la concentration des deux ions à partir de la mesure de ![]()
b. On ne peut pas déterminer la concentration des deux ions à partir de la seule mesure de ![]()
Correction du QCM sur la Conductimétrie en Terminale
Correction 1 : réponse C
Correction 2 : réponse A
On a (loi de Kolrausch) ![]()
Or (neutralité électrique de la solution) ![]()
donc on peut bien déterminer les deux concentrations car ![]()
QCM sur la Mesure des gaz en Terminale
1. Dans la loi des gaz parfaits, on exprime
a. ![]() en L,
en L, ![]() en Pa et
en Pa et ![]() en K
en K
b. ![]() en
en ![]() ,
, ![]() en Pa et
en Pa et ![]() en K
en K
c. ![]() en L,
en L, ![]() en Pa et
en Pa et ![]() en
en ![]()
d. ![]() en
en ![]() ,
, ![]() en Pa et
en Pa et ![]() en
en ![]()
Dans un mètre cube de gaz parfait, on a
a. ![]()
b. ![]()
c. ![]()
d. ![]()
Correction du QCM sur la Mesure des gaz
Correction 1 : réponse B
Le volume molaire dans cette question vaut ![]()
Correction 2 : réponse C
On a
![]()
Mesures Physiques en Terminale : énoncé des exercices
Exercice de pH-métrie : Acide chlorhydrique
L’acide chlorhydrique est le résultat de l’introduction dans l’eau pure de chlorure d’hydrogène ![]()
On donne ![]() ,
, ![]()
![]() ,
, ![]() et
et ![]()
a. Les éléments F, C![]() , Br et I sont dans une même colonne du tableau périodique des éléments, laquelle ? Quelle est la particularité de ces éléments ?
, Br et I sont dans une même colonne du tableau périodique des éléments, laquelle ? Quelle est la particularité de ces éléments ?
b. Justifier que ![]() est une espèce acide. Nommer les acides équivalents en remplaçant le chlore par l’un des autre éléments.
est une espèce acide. Nommer les acides équivalents en remplaçant le chlore par l’un des autre éléments.
c. On introduit dans 1,5 litre d’eau pure ![]() de chlorure d’hydrogène. Écrire la réaction chimique correspondante, supposée totale.
de chlorure d’hydrogène. Écrire la réaction chimique correspondante, supposée totale.
d. Calculer la quantité de matière ![]() dans la solution. En déduire le pH de la solution.
dans la solution. En déduire le pH de la solution.
e. Quels sont le ou les autres ions présents dans la solution ?
Exercice de Spectroscopie : détermination d’une concentration
On réalise le spectre UV d’une solution de concentration ![]() en une espèce X, il est donné sur la figure 1.
en une espèce X, il est donné sur la figure 1.
On réalise des solutions de concentrations ![]() ,
, ![]() , …,
, …, ![]() de cette espèce et on mesure son absorbance pour la longueur d’onde
de cette espèce et on mesure son absorbance pour la longueur d’onde ![]() . On trace, sur la figure 2, la courbe d’étalonnage donnant
. On trace, sur la figure 2, la courbe d’étalonnage donnant ![]() en fonction de
en fonction de ![]() .
.
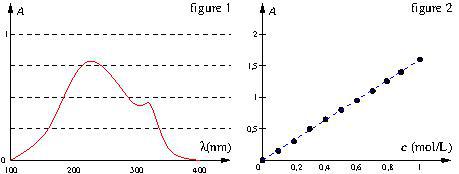
a. Pourquoi travaille-t-on à ![]() pour tracer la courbe d’étalonnage ?
pour tracer la courbe d’étalonnage ?
b. Que prouve la forme de la courbe d’étalonnage .
c. On mesure l’absorbance ![]() . Quelle est la concentration
. Quelle est la concentration ![]() de la solution ?
de la solution ?
Exercice de Conductimétrie : Salinité d’une eau de mer
On donne les conductivités molaires ioniques
![]()
![]()
![]()
![]()
et les masses molaires ![]() ,
, ![]() ,
, ![]() et
et ![]()
On dissout une masse ![]() inconnue de sel marin (chlorure de sodium) dans 1,00 L d’eau pure.
inconnue de sel marin (chlorure de sodium) dans 1,00 L d’eau pure.
a. Dans l’eau pure, pH=7, en déduire ![]() et
et ![]()
b. Pourquoi la dissolution du sel ne fait-elle pas varier le pH ?
c. On mesure la conductivité ![]()
En déduire la concentration ![]() en chlorure de sodium apporté.
en chlorure de sodium apporté.
d. Calculer la masse ![]() .
.
Exercice de Mesure des gaz : électrolyse
On réalise l’électrolyse (voir le chapitre correspondant) d’une solution d’acide sulfurique et on recueille de dihydrogène gazeux dans une éprouvette et du dioxygène gazeux dans l’autre selon la réaction
![]()
Les volumes respectifs sont ![]() et
et ![]()
a. Les volumes recueillis sont-ils cohérents avec l’équation de la réaction ?
b. Le volume molaire, dans les conditions de l’expérience, vaut ![]()
Calculer les quantités de matière correspondantes.
COURS PARTICULIERS EN LIGNE
Nous avons sélectionné pour vous les meilleurs professeurs particuliers.
POUR ACCÉLÉRER MA PROGRESSION
Avis Google France ★★★★★ 4,9 sur 5
Correction des exercices de Mesures Physiques de Terminale
Correction de l’exercice sur l’Acide chlorhydrique
a. Ce sont les halogènes, dans l’avant-dernière colonne. Il leur manque un seul électron pour avoir leur couche externe saturée et acquérir ainsi la structure électronique du gaz noble qui vient à leur suite sur la ligne.
b. La différence d’électronégativité vaut
![]()
donc la liaison est polarisée. Quand la liaison se rompt, l’atome de chlore conserve l’unique électron de l’atome d’hydrogène, il y a donc libération d’un ion hydrogène, ce qui correspond à la définition d’une espèce acide.
* Le fluorure d’hydrogène donne l’acide fluorhydrique
* Le chlorure d’hydrogène donne l’acide chlorhydrique
* Le bromure d’hydrogène donne l’acide bromhydrique
* L’iodure d’hydrogène donne l’acide iodhydrique.
c. ![]()
d. On a
![]()
On en déduit
![]()
C’est une valeur inférieure à 7, la solution est acide, ce qui est logique !
e. On trouve l’ion chlorure ![]() et l’ion hydroxyde
et l’ion hydroxyde ![]() issu de l’autoprotolyse de l’eau.
issu de l’autoprotolyse de l’eau.
Correction de l’exercice sur la Concentration
a. C’est la longueur d’onde correspondant au maximum d’absorption.
b. Les points sont alignés sur une droite passant par l’origine. ![]() est donc proportionnelle à
est donc proportionnelle à ![]() : ceci prouve la validité de la loi de Beer-Lambert.
: ceci prouve la validité de la loi de Beer-Lambert.
c. On reporte la valeur de ![]() sur la droite d’étalonnage. On lit en abscisse
sur la droite d’étalonnage. On lit en abscisse ![]()
Correction de l’exercice sur la Salinité de l’eau de mer
a. Par définition du pH
![]()
L’eau pure étant électriquement neutre, on a
![]()
b. Aucun des deux ions sodium et chlorure n’est acide ou base, il n’y a donc ni libération ni capture d’ion hydrogène.
c. Par application de la loi de Kolrausch
![]()
![]()
Les concentrations des ions hydroxyde et oxonium étant très petites, on peut négliger les deux conductivités correspondantes.
De plus, la dissolution du chlorure de sodium apporte autant des deux ions, donc
![]()
On a donc
![]()
donc ![]()
![]()
On peut vérifier rétrospectivement que les conductivités des ions hydroxyde et oxonium sont bien négligeables.
d. La quantité de matière de chlorure de sodium apporté vaut donc
![]()
On en déduit
![]()
UN APPRENTISSAGE DYNAMIQUE ET COMPLET EN PHYSIQUE
Le confort de l'apprentissage chez vous
Correction de l’exercice sur l’Électrolyse
a. D’après la loi des gaz parfaits, le volume est proportionnel à la quantité de matière, et indépendant de la nature chimique des constituants. Le volume de dihydrogène est le double de celui de dioxygène, c’est cohérent avec les coefficients stœchiométriques de l’équation de la réaction.
b. On a
![]()
![]()
Retrouvez toutes les annales du bac de physique-chimie pour s’entraîner sur les Mesures Physiques et toutes les autres matières. Mesurez l’importance de chacune grâce à notre simulateur du bac, pour identifier les points à gagner pour ne pas être déçu le jour des résultats du bac.
Si certains chapitres demeurent compliqués, n’hésitez pas à utiliser nos différents cours en ligne de physique-chimie du programme de terminale, par exemple :

