Chapitres Physique-Chimie en Terminale Générale
Exercices sur le titrage Terminale Générale
Résumé de cours Exercices et corrigés
Cours en ligne de Physique-Chimie en Terminale
Le titrage, essentiel en chimie de Terminale Générale, implique la détermination de la concentration d’une solution grâce à une réaction avec un réactif de concentration connue. C’est un excellent moyen d’apprendre les bases des réactions acido-basiques et de la stoichiométrie.
Pour renforcer vos acquis sur le titrage, envisagez des cours particuliers en physique-chimie. Un professeur particulier peut offrir une attention personnalisée, aidant à clarifier les notions et à pratiquer des exercices spécifiques, ce qui est important pour maîtriser ce chapitre important.
Exercice sur le titrage colorimétrique
On donne les deux couples oxydant-réducteur
![]() et
et ![]()
L’ion permanganate donne à une solution une teinte violette plus intense que les autres couleurs dues aux autres ions présents.
Une solution contient des ions fer (II), de concentration ![]() inconnue.
inconnue.
On réalise un dosage colorimétrique de ces ions par une solution de permanganate de potassium acidifiée, de concentration ![]()
a. Écrire la réaction de titrage.
b. Pourquoi la solution de permanganate de potassium doit-elle être acidifiée ?
c. Expliquer comment on procède expérimentalement au titrage colorimétrique et comment on repère, à l’œil, l’équivalence.
d. On procède au titrage d’un volume ![]() de la solution contenant les ions fer (II). L’équivalence est atteinte pour un volume de solution de pemanganate de potassium versé
de la solution contenant les ions fer (II). L’équivalence est atteinte pour un volume de solution de pemanganate de potassium versé ![]() .
.
Calculer ![]()
COURS DE PHYSIQUE-CHIMIE
Nous avons sélectionné pour vous les meilleurs profs particuliers.
POUR ACCÉLÉRER MA PROGRESSION EN PHYSIQUE-CHIMIE, JE TROUVE DES
Avis Google France ★★★★★ 4,9 sur 5
Exercice sur le titrage de l’ion sulfate dans l’eau minérale
Une eau minérale possède une concentration massique en ions sulfate ![]()
![]()
On donne ![]()
![]()
a. Calculer la concentration molaire ![]() dans l’eau minérale.
dans l’eau minérale.
b. On réalise le titrage des ions sulfate grâce à une solution titrante de chlorure de baryum (![]() )
)
La réaction de titrage est
![]()
Quel type de suivi de titrage peut-on envisager (les ions en solution ne donnent aucune couleur visible) ?
c. Le titrage est fait sur un échantillon prélevé de ![]() d’eau minérale.
d’eau minérale.
La solution titrante placée dans la burette a pour concentration ![]()
Quel est le volume ![]() de solution versée à l’équivalence ?
de solution versée à l’équivalence ?
Exercice sur le titrage conductimétrique du chlorure de baryum
On réalise le titrage conductimétrique d’une solution de chlorure de baryum
(![]() )
)
On donne les conductivités molaires ioniques, exprimées en ![]()
![]()
![]()
![]()
![]()
On note ![]() la concentration (inconnue) de chlorure de baryum dans la solution et on la titre par une solution d’acide sulfurique de concentration
la concentration (inconnue) de chlorure de baryum dans la solution et on la titre par une solution d’acide sulfurique de concentration
![]()
On prélève un volume ![]() de la solution de chlorure de baryum, on ajoute de l’eau distillée pour obtenir
de la solution de chlorure de baryum, on ajoute de l’eau distillée pour obtenir ![]() de solution, on place l’acide sulfurique dans la burette, on introduit la cellule conductimétrique dans la solution et on verse doucement la solution titrante. On relève l’évolution de la conductivité
de solution, on place l’acide sulfurique dans la burette, on introduit la cellule conductimétrique dans la solution et on verse doucement la solution titrante. On relève l’évolution de la conductivité ![]() en fonction du volume
en fonction du volume ![]() d’acide sulfurique versé.
d’acide sulfurique versé.
La réaction de titrage est
![]()
On obtient la courbe suivante.
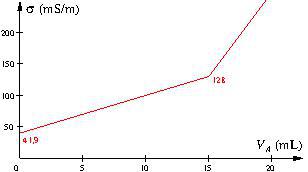
a. Pourquoi dilue-t-on la solution dans le bécher ?
b. Exprimer les concentrations dans le bécher lorsque le volume d’acide sulfurique versé est nul
![]() et
et ![]() en fonction de
en fonction de ![]()
c. Grâce à la loi de Kolrausch, en déduire l’expression de ![]() dans la solution en fonction de
dans la solution en fonction de ![]() .
.
d. En déduire la valeur de ![]() .
.
e. Vérifier que la valeur obtenue est compatible avec la forme de la courbe de conductimétrie.
f. À l’équivalence, faire l’inventaire des espèces ioniques présentes dans la solution et donner leurs concentrations.
g. Vérifier la valeur de ![]() à l’équivalence indiquée sur le graphique.
à l’équivalence indiquée sur le graphique.
Exercice sur le dosage de l’acide lactique
Le lait contient un acide lactique noté AH dont la base conjuguée est l’ion lactate ![]() .
.
On introduit dans un bécher ![]() de lait, de concentration
de lait, de concentration ![]() inconnue, et on lui ajoute 100 mL d’eau et quelques gouttes de phénolphtaléine, dont la zone de virage est 8,2-9,8, incolore à pH inférieur, rose à pH supérieur.
inconnue, et on lui ajoute 100 mL d’eau et quelques gouttes de phénolphtaléine, dont la zone de virage est 8,2-9,8, incolore à pH inférieur, rose à pH supérieur.
On introduit dans la burette une solution de soude, hydroxyde de sodium
(![]() ) de concentration
) de concentration ![]()
On laisse s’écouler doucement la solution de soude dans le bécher et on repère le changement de couleur pour un volume versé
![]()
a. Écrire la réaction de titrage.
b. Le pH à l’équivalence vaut 8,5. En déduire la valeur de ![]()
c. La masse molaire de l’acide lactique vaut
![]()
En déduire la concentration massique ![]() de l’acide lactique dans le lait.
de l’acide lactique dans le lait.
d. 1 degré Dornic correspond à 0,1 g d’acide lactique par litre de lait. Le lait est « frais » si son acidité est inférieure à 18 degrés Dornic. Conclure sur le lait dosé.
Correction de l’exercice sur le titrage colorimétrique
a. Les demi-équations s’écrivent
![]()
![]() et
et ![]()
En multipliant la seconde équation par 5, on en déduit
![]()
![]()
b. L’ion hydrogène est un réactif dans la réaction d’oxydo-réduction.
c. On place la solution à titrer dans un bécher et la solution titrante de permanganate de potassium dans la burette. On place un barreau aimanté dans le bécher et on lance l’agitation.
On verse progressivement le permanganate de potassium dans le bécher.
Avant l’équivalence, tout le permanganate versé est consommé, la solution n’a pas de teinte violette (au moment où la goutte tombe, on voit une teinte violette fugace qui disparaît avec l’agitation).
L’équivalence est atteinte quand la teinte violette perdure.
Notons qu’on fait souvent un titrage rapide, où on repère approximativement le volume d’équivalence, puis un deuxième titrage où on ralentit autour de ce volume pour plus de précision.
d. À ‘équivalence, les réactifs sont introduits dans les proportions stœchiométriques donc
![]()
donc ![]()
![]()
Correction de l’exercice sur le titrage de l’ion sulfate
a. On calcule
![]()
![]()
On en déduit
![]()
![]()
b. La réaction met en jeu des ions donc on peut envisager un titrage conductimétrique.
Il n’y a pas d’ion hydrogène, donc on exclut un titrage pH-métrique, et l’absence de couleur exclut un titrage colorimétrique.
c. À l’équivalence
![]() donc
donc
![]()
COURS PARTICULIERS EN LIGNE
Nous avons sélectionné pour vous les meilleurs professeurs particuliers.
POUR ACCÉLÉRER MA PROGRESSION
Avis Google France ★★★★★ 4,9 sur 5
Correction exercice titrage conductimétrique chlorure baryum
a. On dilue la solution pour pouvoir négliger les effets de la dilution dans l’évolution de la conductivité, les volumes de solution titrante sont petits devant celui de la solution dans le bécher, qui varie donc très peu : on obtient ainsi des segments de droite.
b. La solution a été diluée dix fois, on en déduit que
![]()
et comme il y a deux ions chlorure pour un ion baryum dans la solution
![]()
c. On en déduit
![]()
d. On lit sur le graphique
![]()
On en déduit que
![]()
donc ![]()
soit ![]()
e. L’équivalence est atteinte au point de cassure de la courbe, pour ![]()
On en déduit
![]() donc
donc
![]()
qui est bien la valeur trouvée à la question précédente.
f. À l’équivalence, les ions baryum et les ions sulfate ont totalement disparu, il reste les ions chlorure initialement présents
![]()
soit ![]()
et les ions hydrogène introduits (il y en a deux pour chaque ion sulfate)
![]()
soit ![]()
g. On en déduit, par application de la loi de Kolrausch
![]()
soit ![]() qui est conforme à la valeur indiquée sur le graphique.
qui est conforme à la valeur indiquée sur le graphique.
Correction exercice dosage acide lactique
a. La réaction de titrage s’écrit
![]()
b. Le pH à l’équivalence est dans la zone de virage de la phénolphtaléine, donc
![]()
Or à l’équivalence
![]() donc
donc
![]()
c. On en déduit
![]()
d. Cette concentration correspond à 22 degrés Dornic, valeur supérieure à 18. Le lait n’est donc pas frais.
Consultez d’autres chapitres de Physique-Chimie de Terminale, pour bien vous entraîner au Bac.
- Exercices bac sur la cinétique chimique
- Evolution spontanée d’un système chimique : Exercices
- Exercice terminale : mécanismes réactionnels
- Exercices sur les piles en terminale
- Exercices sur les forces des acides et des bases
- Résumé de cours cinétique chimique terminale
- Cours sur l’équilibre chimique type bac

