Chapitres Physique-Chimie en Terminale Générale
Cours sur la force des Acides et Bases en Terminale Générale
Résumé de cours Exercices et corrigés
Cours en ligne de Physique-Chimie en Terminale
Les élèves qui ont choisi la spécialité physique-chimie en première et en terminale doivent être attentifs à ne pas négliger les chapitres de physique-chimie lors de leurs révisions pour le baccalauréat. Le programme de physique-chimie en terminale est assez lourd et peut sembler fastidieux. Afin de ne pas se perdre dans leurs révisions, les élèves de terminale peuvent bénéficier d’un prof en physique chimie, ce qui leur permettra d’assimiler rapidement les bonnes méthodes de travail. Cela leur garantira également d’avoir bien compris l’ensemble des chapitres nécessaires pour réussir l’épreuve du bac.
A. Produit ionique de l’eau en Terminale
1. Réaction d’autoprotolyse de l’eau en Terminale
La réaction d’autoprotolyse de l’eau a pour équation
![]()
C’est une réaction acide/base
L’une des molécules d’eau joue le rôle d’acide en libérant un ion hydrogène et se transforme en l’ion hydroxyde ![]()
L’autre molécule d’eau joue le rôle de base en capturant l’ion hydrogène et se transforme en l’ion hydronium ![]()
Cette réaction équilibrée a une constante d’équilibre appelée produit ionique de l’eau, égale au quotient de réaction à l’équilibre
![]()
À ![]() , on a
, on a ![]()
Sauf mention du contraire, on supposera toujours qu’on travaille à cette température.
2. Relation entre les concentrations en hydroxyde et en hydronium
Relation entre les concentrations en hydroxyde et en hydronium dans une solution aqueuse :
En solution aqueuse, l’équilibre de la réaction d’autoprotolyse reste toujours établi et la relation suivante est toujours vérifiée
![]()
3. Solution aqueuse acide, basique en Terminale
![]() Si pH =7,0
Si pH =7,0 ![]()
La solution est neutre.
Si pH est strictement inférieur à 7, ![]() donc
donc ![]()
Il y a plus d’ions hydronium que d’ions hydroxyde. La solution est acide.
Si pH est strictement supérieur à 7, ![]() donc
donc ![]()
Il y a moins d’ions hydronium que d’ions hydroxyde. La solution est basique.
Tu veux réussir en physique chimie ?
Accède aux meilleurs exercices et résumés de cours
Travaille sur les annales en autonomie
Fais toi accompagner en cours à domicile
Les élèves que nous aidons en cours de physique -chimie à domicile recommandent à 98% nos profs
Avis Google France
★★★★★ 4,9 sur 5
B. Force des acides /bases en Terminale
1. Réaction entre un acide et l’eau en Terminale
Une espèce acide ![]() en solution aqueuse réagit avec l’eau solvant
en solution aqueuse réagit avec l’eau solvant
![]()
Cette réaction est un équilibre chimique, caractérisé par une constante d’équilibre ne dépendant que de la température.
Si cette constante d’équilibre est très grande devant 1 (on prend en général un seuil égal à ![]() ), la réaction est totale et il y a disparition complète de AH. On remplace alors la flèche double par une flèche simple.
), la réaction est totale et il y a disparition complète de AH. On remplace alors la flèche double par une flèche simple.
2. Acide fort en Terminale Général
Si la réaction entre AH et l’eau est totale
![]()
et on dit que AH est un acide fort.
Soit ![]() la concentration introduite en AH dans l’eau pure. Alors
la concentration introduite en AH dans l’eau pure. Alors
![]()
3. Acide faible en Terminale Générale
Lorsque la constante d’équilibre de la réaction entre un acide AH et l’eau est inférieure à 1,
![]()
Cette réaction est équilibrée et il y a coexistence, à l’équilibre, entre l’espèce acide et l’espèce basique.
On dit alors que AH est un acide faible.
La constante d’équilibre est appelée la constante d’acidité et est notée ![]()
Elle est égale au quotient de réaction à l’équilibre
![]()
On note ![]() et réciproquement
et réciproquement ![]()
4. Base forte en Terminale
Si la réaction entre une espèce basique B et l’eau est totale
![]()
Et on dit que B est une base forte.
Soit ![]() la concentration introduite en AH dans l’eau pure. Alors
la concentration introduite en AH dans l’eau pure. Alors
![]()
5. Base faible en Terminale
Lorsque la constante d’équilibre de la réaction entre une base B et l’eau est inférieure à 1,
![]()
Cette réaction est équilibrée et il y a coexistence, à l’équilibre entre l’espèce basique et l’espèce acide.
On dit alors que B est une base faible.
6. Force d’un acide faible en Terminale
On rappelle que le taux d’avancement final d’une réaction équilibrée est
![]()
Lorsqu’on introduit un acide faible AH dans un volume ![]() d’eau, avec une concentration apportée
d’eau, avec une concentration apportée ![]() , voici le tableau d’avancement
, voici le tableau d’avancement
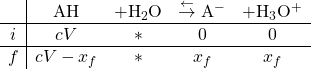
L’avancement maximal vaut donc ![]() et l’avancement final
et l’avancement final ![]() avec
avec
![]()
Et ![]()
Donc ![]()
On en déduit que
![]()
![]()
Un acide faible est d’autant plus fort que son taux d’avancement est grand.
Les relations précédentes prouvent que, pour une concentration ![]() introduite fixée, plus un acide est fort,
introduite fixée, plus un acide est fort,
Plus le ![]() du couple est grand
du couple est grand
Plus ![]() est grand
est grand
Plus le ![]() du couple est petit
du couple est petit
Plus le pH est petit
Donc plus la solution est acide.
Le ![]() est donc un indicateur de la force d’un acide faible. Voici un diagramme en faisant apparaître quelques uns.
est donc un indicateur de la force d’un acide faible. Voici un diagramme en faisant apparaître quelques uns.
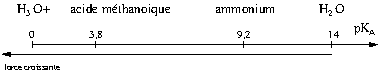
7. Force d’une base faible en Terminale
De même que pour les acides faibles, une base faible B est d’autant plus forte que le taux d’avancement de la réaction
![]()
est grand.
Plus une base est forte,
Plus le ![]() du couple est petit
du couple est petit
Plus ![]() est petit et
est petit et ![]() est grand
est grand
Plus le ![]() du couple est grand
du couple est grand
Plus le pH est grand
Donc plus la solution est basique.
COURS PARTICULIERS EN LIGNE
Nous avons sélectionné pour vous les meilleurs professeurs particuliers.
POUR ACCÉLÉRER MA PROGRESSION
Avis Google France ★★★★★ 4,9 sur 5
C. Optimisation de synthèse en Terminale
1. Acide ou base faible en solution aqueuse : diagramme de prédominance
Lorsqu’un acide faible AH est en solution aqueuse, il coexiste avec sa base conjuguée ![]()
Réciproquement, la base ![]() coexiste avec son acide conjugué AH,
coexiste avec son acide conjugué AH, ![]() est donc une base faible.
est donc une base faible.
Le couple AH/![]() est donc caractérisé par sa constante d’acidité
est donc caractérisé par sa constante d’acidité ![]() ou par son
ou par son ![]()
En composant la relation définissant la constante d’acidité
![]()
Par la fonction log, on obtient
![]()
![]()
soit ![]()
On rappelle une propriété du logarithme pour ![]()
![]() si et seulement si
si et seulement si ![]()
![]() si et seulement si
si et seulement si ![]()
![]() si et seulement si
si et seulement si ![]()
On en déduit que
Si ![]() alors
alors ![]()
Si ![]() alors
alors ![]()
On peut retenir que si le pH est plus basique (donc supérieur) que le ![]() , c’est l’espèce basique qui prédomine.
, c’est l’espèce basique qui prédomine.
Si ![]() alors
alors ![]()
On peut retenir que si le pH est plus acide (donc inférieur) que le ![]() , c’est l’espèce acide qui prédomine.
, c’est l’espèce acide qui prédomine.
2. Acide ou base faible en solution aqueuse : diagramme de distribution
L’énoncé d’un exercice peut fournir un document plus précis que le diagramme de prédominance : le diagramme de distribution qui indique les pourcentages molaires des espèces acide et base.
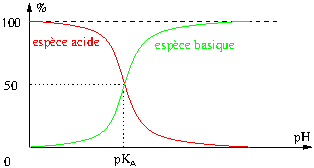
On vérifie que pour ![]() , les concentrations en les espèces acide et basique sont égales.
, les concentrations en les espèces acide et basique sont égales.
3. Acide et base introduits en égales quantités : solution tampon
Si on introduit en concentrations égales un acide faible et sa base conjuguée dans de l’eau pure, on n’observe aucune réaction acide-base et
![]()
On en déduit que ![]()
Cette solution est appelée une solution tampon : son pH varie très peu lorsqu’on y introduit de petites quantités d’acide ou de base.
4. Réaction entre un acide faible et une base faible
Un acide ![]() (
(![]() ) réagit avec une base
) réagit avec une base ![]() (
(![]() ) selon l’équation
) selon l’équation
![]()
La constante de cet équilibre vaut
![]()
Si ![]() alors
alors ![]() , et la réaction sera assez avancée à très avancée
, et la réaction sera assez avancée à très avancée
Si ![]() alors
alors ![]() , et la réaction sera assez à très limitée.
, et la réaction sera assez à très limitée.
On retient donc que la réaction la plus favorable est celle entre un acide le plus fort possible (de ![]() petit) avec une base la plus forte possible (de
petit) avec une base la plus forte possible (de ![]() grand).
grand).
5. Réaction de titrage d’un acide faible par une base forte
L’acide ![]() dont le
dont le ![]() est supposé entre 3 et 9, est titré par une base forte, par exemple l’hydroxyde de sodium
est supposé entre 3 et 9, est titré par une base forte, par exemple l’hydroxyde de sodium ![]()
La réaction de titrage s’écrit
![]()
Sa constante d’équilibre vaut
![]()
Donc ![]() et la réaction de titrage peut être considérée comme totale (ce qui est l’une des propriétés d’une réaction de titrage, totale, rapide et unique).
et la réaction de titrage peut être considérée comme totale (ce qui est l’une des propriétés d’une réaction de titrage, totale, rapide et unique).
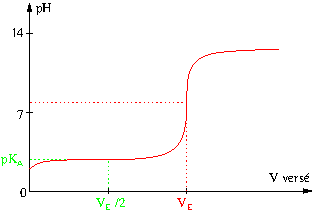
Lorsqu’on a versé la moitié du volume d’équivalence ![]() , on a apporté une quantité d’ions hydroxyde égale à la moitié de l’avancement maximal, donc les concentrations en l’espèce acide et en l’espèce basique sont égales
, on a apporté une quantité d’ions hydroxyde égale à la moitié de l’avancement maximal, donc les concentrations en l’espèce acide et en l’espèce basique sont égales
![]() et
et ![]()
À la demi-équivalence, ![]() et
et ![]()
De plus, la solution est alors une solution tampon donc le pH varie très peu au voisinage de ce point, le coefficient directeur de la tangente à la courbe en ce point est très petit.
Tu veux réussir en chimie ?
Développe ton autonomie et gagne en méthodologie
Des cours dynamiques et non magistraux
Anticipe les notions et les échéances à venir en chimie
Confiez-nous votre besoin et définissons ensemble le professeur idéal en chimie pour votre enfant
Avis Google France
★★★★★ 4,9 sur 5
Il y a bien d’autres chapitres en physique chimie au programme de Terminale qu’il faudra absolument maîtriser pour le Bac. En voici quelques-uns :
- Cours de terminale sur l’évolution forcée d’un système chimique
- Cours niveau bac sur la radioactivité
- Cours sur la chimie organique en terminale
- Cours sur les ondes en terminale
- Cours : l’effet Doppler
- Exercices corrigés type bac sur la force des acides et bases
- Exercices corrigés sur l’équilibre chimique

