Chapitres Physique-Chimie en Terminale Générale
Cours Mesures Physiques terminale générale
Résumé de cours Exercices et corrigés
Cours en ligne de Physique-Chimie en Terminale
Maîtriser vos mesures physiques vous servira dans tous les cours de terminale en Physique Chimie. En cas de lacunes en physique-chimie, les cours particuliers en physique chimie vous permettront de ré-hausser votre niveau pour non seulement être satisfait leur jour des résultats du bac mais aussi pour intégrer le top du classement des prépa MP ou les meilleures prepa PC.
A. Ph-métrie en terminale générale
1. Ion oxonium en solution aqueuse
En solution aqueuse, l’ion hydrogène ![]() échangé dans les réactions acide-base est « solvaté » en l’ion oxonium
échangé dans les réactions acide-base est « solvaté » en l’ion oxonium ![]()
![]()
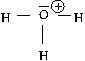
Voici le schéma de Lewis de l’ion oxonium.
2. Ion oxonium en eau pure
L’ion oxonium est présent dans l’eau pure, il est formé en quantité égale à l’ion hydroxyde par l’autoprotolyse de l’eau
![]()
La concentration en ion oxonium dans l’eau pure à ![]() vaut
vaut
![]()
3. Introduction d’une espèce acide dans l’eau
Lorsqu’on introduit une espèce acide dans l’eau, la libération d’ions hydrogène fait augmenter la concentration ![]() et on dit que « la solution est plus acide ».
et on dit que « la solution est plus acide ».
Lorsqu’on introduit une base dans l’eau, la capture d’ions hydrogène fait diminuer la concentration ![]() et on dit que « la solution est moins acide » ou « plus basique ».
et on dit que « la solution est moins acide » ou « plus basique ».
La concentration en ions oxonium est donc un indicateur du caractère acide ou basique d’une solution.
Par définition, le pH est une grandeur associée à cette concentration
![]()
avec ![]() une concentration de référence (ainsi, la fraction dont on prend le logarithme décimal est sans dimension).
une concentration de référence (ainsi, la fraction dont on prend le logarithme décimal est sans dimension).
On tolère aussi l’écriture
![]()
où la concentration ![]() est impérativement exprimée en
est impérativement exprimée en ![]()
Réciproquement
![]()
* Plus la solution est acide, plus ![]() est grand, plus pH est petit.
est grand, plus pH est petit.
* À ![]() , le pH de l’eau pure vaut pH=7,0.
, le pH de l’eau pure vaut pH=7,0.
* Plus la solution est basique, plus ![]() est petit, plus pH est grand.
est petit, plus pH est grand.
* Pour les solutions aqueuses à ![]() ,
, ![]()
Méthode
Pour l’utilisation de la machine
* la touche à utiliser est celle du logarithme décimal en général appelée log sur les calculatrices, pour le distinguer du logarithme népérien (appelé ln)
* la puissance de 10 nécessite la fonction « ![]() » (et pas la touche EXP ou
» (et pas la touche EXP ou ![]() qui est réservée aux puissances de nombres entiers) qui est en général la même touche que log, mais en ayant auparavant tapé shift ou 2nde.
qui est réservée aux puissances de nombres entiers) qui est en général la même touche que log, mais en ayant auparavant tapé shift ou 2nde.
4. La mesure du pH en terminale générale
La mesure du pH est possible grâce à
* du papier pH qui, imbibé de la solution, prend une couleur qui indique la valeur du pH
* un pH-mètre qui, préalablement étalonné, possède une sonde qu’on trempe dans la solution et qui indique directement la valeur du pH sur l’écran.
Les indicateurs colorés (bleu de bromothymol, héliantine, phénolphtaléine, etc.) changent de couleur lorsque le pH de la solution atteint et dépasse une valeur moyenne, on dit qu’il y a « virage »
B. La Spectoscopie en terminale
1. Spectre d’une solution en terminale
Le spectre d’une solution est une courbe donnant une caractéristique radiative en fonction de la longueur d’onde ![]() ou de son inverse, le nombre d’onde
ou de son inverse, le nombre d’onde ![]() , quand celle-ci ou celui-ci varie sur un intervalle déterminé.
, quand celle-ci ou celui-ci varie sur un intervalle déterminé.
Cette caractéristique peut être
* l’absorbance variant de 0 (l’onde électromagnétique (lumineuse) n’est pas du tout absorbée et traverse la solution sans atténuation, la solution est donc transparente pour la longueur d’onde) à 1 (l’onde est complètement absorbée, la solution est opaque pour la longueur d’onde)
* ou la transmittance variant de 0 (l’onde n’est pas du tout transmise, elle est complètement absorbée, la solution est opaque pour la longueur d’onde) à 1 (l’onde est totalement transmise, elle n’est pas du tout absorbée et traverse la solution sans atténuation, la solution est donc transparente pour la longueur d’onde)
Le spectre peut être comparé à un spectre de référence pour identifier une molécule. On peut aussi identifier des particularités du spectre, des pics d’absorption, et en déduire certaines caractéristiques de l’espèce présente en solution.
Le spectroscope est rarement utilisé au lycée, aucune compétence sur le maniement de cet appareil n’est exigée, la courbe est en général fournie par le professeur.
2. Spectre UV-visible
Le spectre UV-visible est un spectre d’absorbance en fonction de la longueur d’onde ![]() dans l’intervalle approximatif [100 nm ; 400 nm] pour les ultraviolets (UV) et dans l’intervalle approximatif [400 nm~;~800 nm] pour le visible.
dans l’intervalle approximatif [100 nm ; 400 nm] pour les ultraviolets (UV) et dans l’intervalle approximatif [400 nm~;~800 nm] pour le visible.
3. Loi de Beer-Lambert
La loi de Beer-Lambert indique que l’absorbance (sans unité) est proportionnelle à la concentration ![]() en l’espèce colorée dans une solution, pour une longueur d’onde
en l’espèce colorée dans une solution, pour une longueur d’onde ![]() donnée
donnée
![]()
où ![]() (exprimé en cm) est la longueur de la cuve de spectroscopie et
(exprimé en cm) est la longueur de la cuve de spectroscopie et ![]() le coefficient d’absorption molaire en
le coefficient d’absorption molaire en ![]()
4. Spectre IR en terminale
Le spectre IR est un spectre de transmittance en fonction de la longueur d’onde pour des longueurs d’onde dans l’intervalle approximatif ![]() donc pour des nombres d’onde
donc pour des nombres d’onde
![]() dans l’intervalle approximatif
dans l’intervalle approximatif
![]() correspondant à l’infrarouge.
correspondant à l’infrarouge.
On fournit avec le spectre un tableau de correspondance entre les pics d’absorption, où la transmittance est proche de 0 et les groupes caractéristiques. On peut ainsi identifier assez précisément la famille à laquelle appartient une molécule organique dont on étudie le spectre IR.
Tu veux réussir en physique ?
Un suivi assidu et des tarifs justes
Des enseignants certifiés et étoilés
Un environnement favorable à la concentration
Des milliers de parents et d’élèves sont satisfaits de leur accompagnement
Avis Google France
★★★★★ 4,9 sur 5
C. La Conductimétrie en terminale générale
1. Conductance des solutions à ions
Les solutions comportant des ions sont conductrices de l’électricité.
Quand on plonge deux électrodes dans une telle solution, et qu’on applique une tension électrique ![]() , mesurée en volts entre ces deux électrodes, on détecte le passage d’un courant électrique d’intensité
, mesurée en volts entre ces deux électrodes, on détecte le passage d’un courant électrique d’intensité ![]() mesurée en ampères. La conductance est le quotient
mesurée en ampères. La conductance est le quotient
![]()
Elle est exprimée en siemens (S). On peut remarquer que c’est l’inverse de la résistance définie pour un conducteur ohmique par la relation ![]()
2. Mesure de la conductance
On mesure la conductance grâce à un conductimètre comportant
* une cellule conductimétrique formée de deux plaques rectangulaires parallèles de même aire ![]() et distantes de
et distantes de ![]()
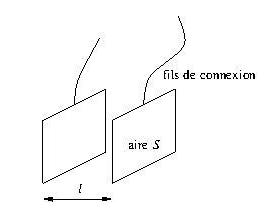
* reliée à un boîtier assurant l’alimentation électrique et effectuant les mesures.
La conductance ![]() dépend de
dépend de ![]() , de
, de ![]() et d’une caractéristique fondamentale de la solution, sa conductivité
et d’une caractéristique fondamentale de la solution, sa conductivité ![]() (à ne pas confondre avec le nombre d’onde du paragraphe précédent)
(à ne pas confondre avec le nombre d’onde du paragraphe précédent)
![]()
La conductivité vaut donc
![]()
où ![]() est exprimée en siemens par mètre (
est exprimée en siemens par mètre (![]() )
)
et ![]() est la constante de cellule exprimée
est la constante de cellule exprimée
en ![]()
Le conductimètre affiche directement la conductivité ![]() .
.
3. Loi de Kolrausch
La loi de Kolrausch donne l’expression de la conductivité ![]() d’une solution comportant des ions en fonction des concentrations de ces ions
d’une solution comportant des ions en fonction des concentrations de ces ions
![]()
* les ions présents dans la solution sont numérotés et repérés par l’indice ![]()
* ![]() est la concentration de l’ion numéroté
est la concentration de l’ion numéroté ![]() , exprimée en
, exprimée en ![]()
Attention au piège ! ![]()
* ![]() est la conductivité molaire ionique de l’ion numéroté
est la conductivité molaire ionique de l’ion numéroté ![]() , elle est donnée par l’énoncé et exprimée en
, elle est donnée par l’énoncé et exprimée en ![]()
Méthode.
Cette formule est difficile à plusieurs titres
* les grandeurs manipulées sont totalement nouvelles, et leur sens physique n’est pas du tout évident pour un élève de Terminale
* leurs unités sont vraiment difficiles à appréhender
* cette formule mêle des grandeurs électriques et des grandeurs chimiques
* cette formule fait apparaître une sommation sur un indice qui parcourt tous les ions présents dans la solution.
Ceci dit, elle devient assez familière quand on l’a beaucoup utilisée, ce qui est un encouragement à faire beaucoup d’exercices pour la maîtriser.
Mais le jeu en vaut la chandelle car quand on la maîtrise, on peut traiter des questions difficiles de BAC, et on hausse son niveau scientifique à celui de l’enseignement supérieur.
COURS PARTICULIERS EN LIGNE
Nous avons sélectionné pour vous les meilleurs professeurs particuliers.
POUR ACCÉLÉRER MA PROGRESSION
Avis Google France ★★★★★ 4,9 sur 5
D. Mesure des gaz en terminale générale
1. Définition du gaz parfait en terminale
Un gaz parfait est un modèle dans lequel
(1) il n’y a pas d’interaction entre les constituants (atomes, molécules) du gaz
(2) le volume propre des constituants est négligeable devant celui de l’enceinte qui le contient.
La pression ![]() en pascals (Pa), le volume
en pascals (Pa), le volume ![]() en mètres cube (
en mètres cube (![]() ), la température absolue (ou thermodynamique)
), la température absolue (ou thermodynamique) ![]() en kelvins (K) et la quantité de matière
en kelvins (K) et la quantité de matière ![]() en moles (mol) sont reliés par la loi des gaz parfaits
en moles (mol) sont reliés par la loi des gaz parfaits
![]()
où ![]() est la constante des gaz parfaits.
est la constante des gaz parfaits.
On rappelle que ![]()
2. Volume molaire des gaz
Le calcul complet d’une grandeur à partir de la loi des gaz parfaits est fastidieux. C’est pourquoi on donne souvent, à la température et à la pression auxquelles on travaille, le volume molaire des gaz
![]()
On en déduit
![]() ou
ou ![]()
Retrouvez toutes les annales du bac de physique-chimie portant sur tout le programme de Physique-Chimie de Terminale. Il est essentiel d’assurer dans cette matière du fait de son fort coefficient au bac : vérifiez sur notre simulateur du bac combien de points vous devrez gagner pour avoir la mention. Pour être certain d’être au niveau le jour du bac, pensez à réviser régulièrement tous les chapitres du programme dont :

