Chapitres Physique-Chimie en Terminale Générale
Exercices sur la force des acides/bases Terminale Générale
Résumé de cours Exercices et corrigés
Cours en ligne de Physique-Chimie en Terminale
Pour maîtriser le sujet de la force des acides et des bases en terminale générale, pratiquez régulièrement avec des exercices dédiés. Cela renforcera votre compréhension de l’échelle de pH, de la constante d’acidité (Ka) et de la réactivité chimique. Les cours particuliers en physique-chimie peuvent également être un atout précieux, offrant un accompagnement personnalisé et approfondi sur ces concepts clés.
Exercice sur une étude conductimétrique de l’acide sulfurique
L’acide sulfurique se dissocie complètement dans l’eau selon la réaction totale
![]()
On donne les conductivités molaires ioniques
![]()
![]()
![]()
On réalise une solution d’acide sulfurique de concentration ![]() apportée inconnue.
apportée inconnue.
On mesure la conductivité de la solution
![]()
a. Pourquoi peut-on prévoir que ![]() est négligeable devant
est négligeable devant ![]() et devant
et devant ![]() ?
?
b. Exprimer ![]() et
et ![]() en fonction de
en fonction de ![]()
c. Par application de la loi de Kohlrausch, en déduire la valeur de ![]()
d. En déduire le pH de la solution.
e. Calculer ![]() et vérifier a posteriori l’affirmation de la question a.
et vérifier a posteriori l’affirmation de la question a.
Exercice de détermination pH d’une solution d’acide faible
Un acide faible AH avec ![]() est mis en solution dans l’eau avec une concentration apportée
est mis en solution dans l’eau avec une concentration apportée ![]()
On suppose que la quantité initiale d’ions hydronium produits par l’autoprotolyse de l’eau est négligeable devant celle apportée par l’acide AH.
a. Montrer qu’à l’équilibre final
![]()
On note ![]() cette concentration.
cette concentration.
En déduire que ![]()
b. En déduire la relation entre ![]() ,
, ![]() et
et ![]()
c. Exprimer cette relation sous la forme d’une équation du second degré en ![]()
d. La résoudre, en déduire la seule valeur admissible pour ![]() et calculer le pH de la solution.
et calculer le pH de la solution.
Exercice sur une solution tampon
On dispose d’une solution d’éthanoate de sodium ![]() de concentration
de concentration ![]() et d’une solution d’acide éthanoïque
et d’une solution d’acide éthanoïque ![]() de concentration
de concentration ![]()
On mélange ![]() de la première et
de la première et ![]() de la deuxième.
de la deuxième.
On obtient ainsi une solution S
Le pH du mélange vaut ![]()
a. Calculer le volume total ![]() de la solution et les concentrations introduites
de la solution et les concentrations introduites ![]() et
et ![]() dans la solution S.
dans la solution S.
b. En déduire la valeur du ![]() du couple.
du couple.
c. Pour vérifier que c’est bien une solution tampon, on effectue une dilution de S en lui ajoutant 100 mL d’eau distillée.
Quelle est la variation du pH ?
d. Pour faire une deuxième vérification, on introduit dans la solution S une quantité de matière
![]()
Écrire la réaction qui se produit, justifier qu’elle est totale, calculer le pH à l’équilibre et calculer la variation de pH de la solution S au cours de l’ajout.
e. Pour comparer la variation de pH à une situation de référence, quelle est la variation de pH si on introduit la même quantité d’ions hydronium dans 300 mL d’eau distillée ?
Exercice de titrage de l’acide ascorbique
L’acide ascorbique, noté ![]() , est un acide faible de masse molaire
, est un acide faible de masse molaire ![]()
Un comprimé de vitamine C est réputé contenir ![]() de cet acide.
de cet acide.
On l’écrase et on le dissout dans une fiole jaugée de 200,0 mL, complétée avec de l’eau distillée jusqu’au trait de jauge, formant ainsi la solution S.
On prélève ![]() de S, on l’introduit dans un bécher et on réalise un titrage pH-métrique avec de la soude (hydroxyde de sodium) de concentration
de S, on l’introduit dans un bécher et on réalise un titrage pH-métrique avec de la soude (hydroxyde de sodium) de concentration ![]()
On obtient la courbe suivante.
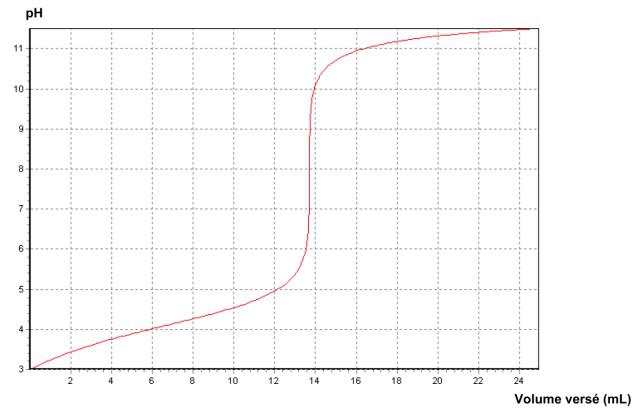
a. Déterminer le volume équivalent ![]()
b. En déduire la concentration ![]() de l’acide ascorbique dans la solution S.
de l’acide ascorbique dans la solution S.
c. En déduire la masse d’acide ascorbique dans le comprimé et commenter le résultat.
d. Déterminer le ![]() de l’acide ascorbique.
de l’acide ascorbique.
Correction exercices étude conductimétrique acide sulfurique
a. La réaction produit des ions hydronium, la solution sera donc acide, d’autant plus acide que ![]() est grande. Dès que le pH est inférieur à 6, la concentration en ions hydronium est supérieure à
est grande. Dès que le pH est inférieur à 6, la concentration en ions hydronium est supérieure à ![]() et d’après le produit ionique de l’eau, la concentration en ions hydroxyde est inférieure à
et d’après le produit ionique de l’eau, la concentration en ions hydroxyde est inférieure à ![]() donc 100 fois plus faible.
donc 100 fois plus faible.
b. La réaction étant totale, un TA permet d’écrire que
![]() et
et ![]()
c. La loi de Kohlrausch s’écrit, en négligeant la contribution des ions hydroxyde à la conductivité
![]()
soit ![]()
donc ![]()
![]()
d. On en déduit ![]()
![]()
e. On a
![]()
donc ![]()
qui est bien négligeable devant ![]()
Correction d’exercice détermination pH solution d’acide faible
a. En notant ![]() le volume de la solution, et
le volume de la solution, et ![]() l’avancement à l’équilibre, on obtient, grâce à un TA
l’avancement à l’équilibre, on obtient, grâce à un TA
![]()
![]()
On en déduit les concentrations en divisant par le volume ![]()
![]()
![]()
et en posant ![]()
donc ![]()
b. On en déduit, par définition de la constante d’acidité
![]()
c. En faisant le produit en crois on obtient
![]()
soit ![]()
soit ![]()
d. Cette équation de discriminant strictement positif admet deux racines (on peut utiliser un solveur)
![]()
![]()
La seconde solution est impossible, elle correspondrait à des quantités de matière négatives de ![]() et de
et de ![]()
On en déduit que
![]()
COURS PARTICULIERS EN LIGNE
Nous avons sélectionné pour vous les meilleurs professeurs particuliers.
POUR ACCÉLÉRER MA PROGRESSION
Avis Google France ★★★★★ 4,9 sur 5
Correction de l’exercice sur une solution tampon
a. ![]()
![]()
![]()
b. Il n’y a aucune réaction chimique qui se produit lors du mélange donc les concentrations dans S à l’équilibre sont égales et d’après la formule du cours
![]()
![]()
donc ![]()
c. L’ajout d’eau ne provoque aucune réaction chimique. Les concentrations restent donc égales et on a toujours ![]()
Le pH ne varie donc pas.
d. La réaction est
![]()
![]()
La constante d’équilibre vaut
![]()
Cette valeur est proche de ![]() , on peut donc considérer que la réaction est totale.
, on peut donc considérer que la réaction est totale.
Les quantités de matière initiales valent
![]()
![]()
et ![]()
C’est l’ion éthanoate qui est en excès.
La réaction étant totale, l’avancement final est égal à l’avancement maximal, soit ![]()
Dressons le TA, ici en millimoles
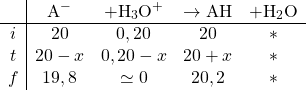
On en déduit les concentrations finales en divisant par le volume ![]()
![]()
![]()
On en déduit
![]()
![]()
![]()
La variation est donc très petite, inférieure à ![]() unité pH.
unité pH.
C’est bien une solution tampon.
e. Dans l’eau, la concentration vaudrait
![]()
donc le pH passerait de 7,0 pour l’eau pure à
![]() soit une variation de 3,5 unités pH environ : l’eau n’est pas une solution tampon.
soit une variation de 3,5 unités pH environ : l’eau n’est pas une solution tampon.
Correction d’exercice sur un titrage d’acide ascorbique
a. Par la méthode des tangentes, on trouve ![]()
b. À l’équivalence,
![]()
donc ![]()
Cette concentration est celle de la solution S car il n’y a pas eu de dilution lors du prélèvement.
c. On en déduit
![]()
donc ![]()
Cette valeur est proche des ![]() annoncés.
annoncés.
La différence peut venir d’une mauvaise dissolution du comprimé dans la fiole.
d. Le ![]() est le pH au point de demi-équivalence.
est le pH au point de demi-équivalence.
Le volume de demi-équivalence vaut ![]()
On lit sur le graphique, pour ![]()
![]()
Consultez d’autres chapitres de Physique-Chimie de Terminale, pour bien vous entraîner au Bac.

