Chapitres Physique-Chimie en Terminale Générale
Exercices sur les piles en physique-chimie en Terminale Générale
Résumé de cours Exercices et corrigés
Cours en ligne de Physique-Chimie en Terminale
Préparez les révisions du bac avec ces exercices corrigés sur le chapitre des piles au programme de physique-chimie en terminale et à l’aide d’un prof particulier physique chimie. Chaque chapitre de physique-chimie en terminale doit être revu avec sérieux et rigueur si l’on veut obtenir de très bons résultats au bac. Des révisions et des entraînements réguliers sur divers types d’exercices sont les clés de la réussite.
Exercice sur la réaction d’oxydoréduction dans une pile
Exercice sur une réaction quasiment totale en terminale
La réaction d’oxydoréduction
![]()
a pour constante d’équilibre ![]()
Dans une solution, la concentration en ions cuivre vaut ![]()
Question 1 :
Calculer la concentration théorique en ions étain pour que la solution soit à l’équilibre.
Question 2 :
Expliquer pourquoi on considère que la réaction est quasiment totale.
COURS DE PHYSIQUE-CHIMIE
Nous avons sélectionné pour vous les meilleurs profs particuliers.
POUR ACCÉLÉRER MA PROGRESSION EN PHYSIQUE-CHIMIE, JE TROUVE DES
Avis Google France ★★★★★ 4,9 sur 5
Exercice sur la description d’une pile en terminale
Exercice sur l’anode sacrificielle.
La réaction spontanée entre le couple du zinc et celui du fer s’écrit
![]()
On fixe, sur la coque en fer d’un bateau, des plots de zinc.
Question 1 :
Que se passe-t-il si, sous l’action des oxydants présents dans l’eau de mer, le fer a tendance à s’oxyder ?
Question 2 :
Pourquoi peut-on considérer que les plots de zinc protègent la coque du bateau ?
Question 3 :
Pourquoi parle-t-on d »’anode sacrificielle » ?
Exercice sur la capacité d’une pile en terminale générale
Exercice sur une pile à combustible.
Les couples mis en jeu dans une pile à combustible sont
![]() et
et ![]()
Voici son schéma de fonctionnement :
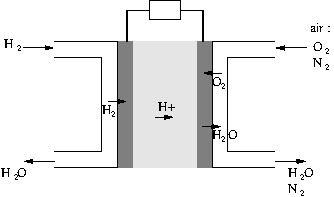
Question 1 :
Identifier l’oxydant et le réducteur de la réaction spontanée d’oxydoréduction.
Question 2 :
Identifier la cathode et l’anode de la pile.
Question 3 :
Dans quel sens le courant circule-t-il dans le dipôle ohmique branché entre les deux électrodes ?
Question 4 :
On dispose d’un réservoir de dihydrogène, qui, à la pression atmosphérique, occuperait un volume ![]() .
.
Dans ces conditions, le volume molaire vaut ![]() .
.
L’air est constitué à ![]() de diazote et à
de diazote et à ![]() de dioxygène.
de dioxygène.
Quel volume d’air atmosphérique est consommé pour faire réagir la totalité du dihydrogène ?
Question 5 :
On donne ![]() . Calculer la capacité
. Calculer la capacité ![]() de la pile.
de la pile.
Question 6 :
Pourquoi la pile à combustible forme-t-elle une très prometteuse alternative aux moteurs thermiques des voitures, et aux batteries qui équipent les voitures à moteur électrique ?
Correction de l’exercice sur la réaction d’oxydoréduction
Question 1 :
À l’équilibre, le quotient de réaction est égal à la constante d’équilibre.
On en déduit :
![]()
donc ![]()
Question 2 :
Cette valeur est impossible à atteindre en solution aqueuse, où la concentration d’un ion ne peut pas dépasser environ une mole par litre.
Il faudrait donc que la concentration en ions cuivre soit de l’ordre de ![]() moles par litre, ce qui correspond à une disparition presque complète des ions cuivre, la réaction est donc quasiment totale.
moles par litre, ce qui correspond à une disparition presque complète des ions cuivre, la réaction est donc quasiment totale.
Correction de l’exercice sur la description d’une pile
Question 1 :
Le fer qui s’oxyde produit des ions ![]() qui réagissent spontanément avec le zinc métallique en reformant du fer métallique.
qui réagissent spontanément avec le zinc métallique en reformant du fer métallique.
Question 2 :
Le zinc s’oxyde donc à la place du fer, c’est donc lui qui se dégrade, le fer de la coque reste intact. Il y a donc protection de la coque.
Question 3 :
Une oxydAtion se produit à l’Anode de zinc. Le zinc s’oxyde à la place du fer qu’il protège.
Le plot de zinc forme donc bien une anode sacrificielle.
COURS DE CHIMIE
Nous avons sélectionné pour vous les meilleurs profs particuliers.
POUR ACCÉLÉRER MA PROGRESSION EN CHIMIE, JE TROUVE DES
Avis Google France ★★★★★ 4,9 sur 5
Correction de l’exercice sur la capacité d’une pile en terminale
Question 1 :
Les demi-équations s’écrivent
L’Oxydant Obtient des électrons, c’est le dioxygène (ce qui est logique, le mot oxydant et le mot oxygène ont la même racine).
Le réduCteur Cède des électrons, c’est le dihydrogène.
Question 2 :
À la Cathode, il y a réduCtion, c’est donc l’électrode de la demi-pile à hydrogène.
À l’Anode, il y a oxydAtion, c’est donc l’électrode de la demi-pile à oxygène.
Question 3 :
Les électrons sont consommés au niveau de la demi-pile à oxygène, fournis au niveau de la demi-pile à hydrogène.
Le sens du courant est le sens opposé de celui des électrons, donc le courant circule de droite à gauche.
Question 4 :
La quantité de matière de dihydrogène vaut :
![]()
La réaction s’écrit : ![]() avec l’échange de
avec l’échange de ![]() électrons.
électrons.
La quantité de matière de dioxygène nécessaire vaut donc : ![]()
Cette valeur est aussi l’avancement final de la réaction.
Il faut donc une quantité de matière d’air :
![]()
ce qui représente un volume :
![]()
Question 5 :
La capacité de la pile vaut : ![]()
Question 6 :
La pile ne nécessite pas de batterie, objet dont la fabrication nécessite des matériaux rares et dont le recyclage est problématique, ce qui entraîne un coût énergétique important sur la totalité du cycle de vie.
Elle rejette de l’eau à la sortie du pot d’échappement, ce qui est évidemment un progrès environnemental considérable par rapport aux moteurs à carburants fossiles.
COURS PARTICULIERS DE PHYSIQUE
Nous avons recruté pour vous les meilleurs profs de physique.
POUR M'AMÉLIORER EN PHYSIQUE, JE CHERCHE DES
Avis Google France ★★★★★ 4,9 sur 5
Bien connaître ses cours de physique-chimie au programme de terminale, est évidemment nécessaire pour l’épreuve du bac, mais il est d’autant plus important de les maîtriser étant donné que la physique-chimie est une épreuve de spécialité. Par conséquent, son coefficient au bac est relativement élevé, puisqu’il est de 16.
Il est alors important, de fournir un travail régulier tout au long de son année scolaire, pour ce faire, les élèves sont vivement incités à compléter leurs connaissances à l’aide des cours en ligne de physique-chimie au programme de terminale, notamment :

